
ABSTRACT
结直肠癌(CRC)是造成癌症死亡和发病的主要原因。尽管化疗和靶向治疗取得了进展,但由于复发和治疗耐药性,临床获益不可持续。癌症患者的免疫状态可能影响疾病治疗的效果。T细胞受体(TCR)库的动态变化可能是监测治疗反应的临床参数。在这项研究中,作者主要确定TCR库在不可切除的转移性结直肠癌(mCRC)患者中的特征和临床意义。在此,作者综合分析了来自20名健康对照者和16名结直肠癌患者的103份外周血样本,随访98至452天,利用高通量测序技术确定TCRα和TCRβ基因库的高变重排。发现,与健康对照相比,mCRC患者的TCRα、TCRβ和CDR3克隆型发生了改变。治疗后,大多数mCRC患者的TCR库和CDR3克隆型的多样性下降。此外,与基线TCR多样性相比,治疗期间TCR多样性显著下降的患者有更好的治疗反应,包括更低的CEA和CA19-9水平和更小的肿瘤大小。TCR基线多样性也与部分反应(PR)状态显著相关(优势比:5.29,p = 0.04)。总之,本研究证明了化疗期间TCR多样性的动态变化与临床结果之间的关联,以及TCR库在预测癌症治疗预后方面的潜在效用。
研究背景
结直肠癌(CRC)是世界上最常见的癌症之一。它仍然是全球男性和女性癌症死亡率和发病率的主要原因(1,2)。对于大多数手术结直肠癌患者,肿瘤复发或转移仍然是一个主要挑战;大多数复发发生在手术后2年内,90%发生在手术后5年内。活性药物和生物标志物驱动的治疗选择的进展改善了转移性结直肠癌患者的预后。然而,不可持续的临床效益被注意到,复发和治疗耐药性正在成为有限的临床改善的主要原因。
早期发现肿瘤复发和监测治疗结果可以给医生更多的时间进行疾病管理。成像技术,包括计算机断层扫描(CT)或磁共振成像(MRI),可用于测量随访患者的肿瘤大小。
然而,由于辐射副作用,这些检查不能经常进行(3)。血清癌胚抗原(CEA)和碳水化合物细胞表面抗原19-9 (CA19-9)被推荐作为CRC的肿瘤标志物,用于肿瘤检测和治疗反应监测。然而,它们的敏感性和特异性问题限制了它们的临床应用(4-6)。因此,生物标志物研究包括治疗耐药性的早期检测,并确保患者接受尽可能多的积极治疗是必要的。
近年来,免疫调节疗法被大量批准用于癌症治疗。T淋巴细胞是适应性免疫中的关键免疫细胞,通过特异性受体介导的肿瘤相关抗原识别,负责抗肿瘤免疫反应。T细胞受体(TCR)库是指在任何给定时间个体免疫系统中具有功能多样性的T细胞的总和。大多数TCR由α链和β链组成,其余的则由γ链和δ链组成。TCR库可以被认为是人类免疫状态的一面镜子,其动态变化可能是监测免疫调节疗法的一个有希望的生物标志物(7)。因此,在某些生理和病理条件下分析T细胞的免疫库特征提供了T细胞克隆分布和功能的上下文依赖信息(8-10)。TCR的特异性和多样性主要来源于高度可变的互补决定区3 (CDR3)和V(D)J区随机重排和连接区突变(11)。一些研究表明,TCR和CDR3的多样性在癌症的诊断、治疗和预后中很重要(12-17)。进行无创外周血库分析为监测癌症患者的TCR库提供了信息,以进行比较(18)。监测治疗后特异性T细胞克隆分布有助于说明治疗是否有效,是评价治疗疗效、判断复发、转移及预后的重要参考价值。
尽管一些研究描述了TCR库多样性在CRC中的肿瘤学意义,但仅分析了CDR3谱型(19-21)。目前仍缺乏TCR库的综合分析研究,以及在治疗期间监测TCRα和TCRβ库动态的纵向队列研究,以及阐明T细胞在癌症进展和治疗中的功能后果。在本研究中,作者使用高通量测序来全面分析治疗期间不可切除转移性结直肠癌患者的TCRα和TCRβ谱。旨在为在无创方法下监测治疗反应提供临床见解,并证明了TCR多样性与临床结果的关联,以及TCR谱在癌症预后中的潜在效用。
研究方法
-
研究群体
-
单核细胞的分离及RNA的提取
-
TCRα和TCRβ基因的多重PCR扩增及高通量测序
-
免疫受体库的生物信息学和统计分析
研究结果
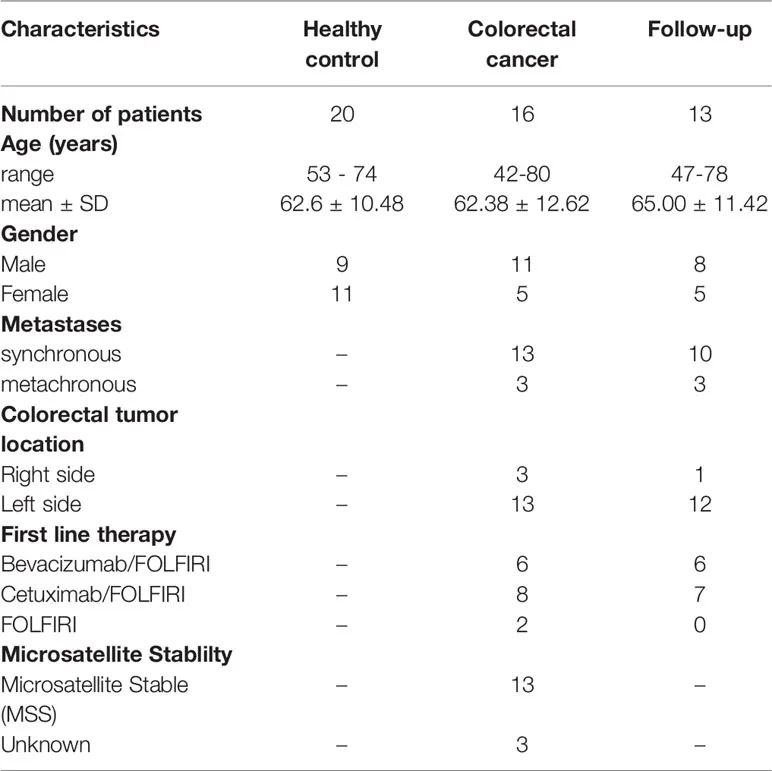
表1 健康和结肠癌患者的研究对象特征。
入选受试者的临床特征,包括CEA和CA19-9水平、肿瘤大小、治疗反应、白细胞计数,列于表1。
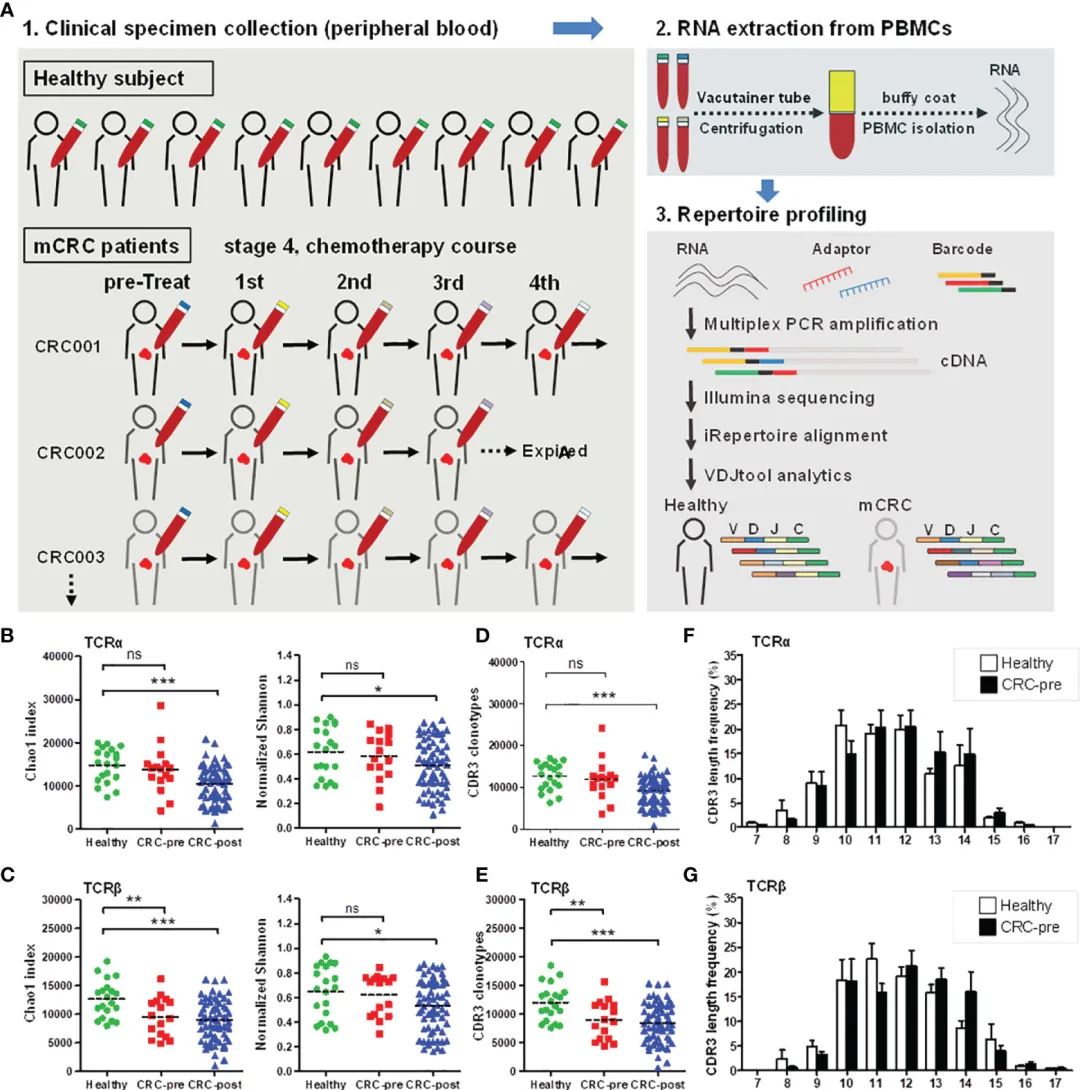
图1 结直肠癌患者和健康对照TCRa和TCRb谱及CDR3长度分布。
注:
A)当前实验设计示意图。
(B, C)健康对照组TCRa (B)和TCRb (C)基因库的Chao1和Shannon指数(healthy;绿色的圆圈)。治疗前CRC患者(CRC-pre;红色方块),随访治疗患者(CRC-post;使用VDJtools软件对蓝色三角形进行测序和分析,结果以柱状散点图中的平均值±SEM表示。使用VDJtools分析确定健康、CRC-pre和CRC-post库的
(D, E) TCRa (D)和TCRb (E) CDR3克隆型,受试者CDR3克隆型数量以柱状散点图表示。
(F, G)健康(白色列)和CRC-pre(黑色列)TCRa (F)和TCRb (G)基因库中的CDR3编码长度和频率,用VDJtools分析得到氨基酸长度谱(x轴)和相应频率(y轴)用柱状图表示。
作者分析了来自16名转移性结直肠癌患者和20名年龄匹配的健康对照者的103份外周血样本。结肠镜检查未发现息肉或癌组织的健康志愿者被纳入研究。在这16例CRC患者中,随访组确定了13例患者,每2个月可获得治疗后样本,随访约452天;研究设计如图1A所示。
化疗后结直肠癌患者TCRα和TCRβ基因库的多样性显著降低,表明TCR基因库动态与化疗治疗之间存在关联(图1)。
接下来,作者比较了不同组间的TCR多样性。TCRα库中健康对照和CRC-pre患者的Chao1和Shannon指数相似(图1B)。在TCRβ全表分析中,与健康对照组相比,CRC-pre患者的Chao1指数显著降低(图1C,左图),而健康对照组和CRC-pre患者的Shannon指数相似(图1C,右图)。
在TCRα和TCRβ库中,CRC后患者的Chao1和Shannon指数与健康对照组相比均显著降低(图1B, C)。
之后在TCRα基因库中观察到,CRC前期患者和健康对照组的CDR3克隆型相似;然而,在CRC-post患者中,它们显著降低(图1D)。此外,与健康对照组相比,TCRβ CDR3克隆型的减少表明CRC前和CRC后患者的Chao1多样性减少(图1E),因此提示健康对照组和CRC患者的CDR3组装存在差异表达。这些结果表明,在化疗过程中,TCR库谱发生了变化。
CDR3编码频率分析显示,在健康对照组和CRC前期患者中,CDR3区域的大致肽长度(10至14个氨基酸)(图1F, G),并且在组间没有发现有偏见的CDR3编码模式。

图2 多维尺度和系统发育分析显示TCR基因库的CDR3克隆型具有相似性
基于TCRα或TCRβ CDR3克隆型的多维尺度分析显示个体样本的表达谱不同(图2A),这表明TCR库的发展是一个长期和多因素的过程。
此外,CDR3克隆型的系统发育分析表明,在健康对照组和CRC前期患者中没有观察到排他的TCRα和TCRβ库簇(图2B)。健康对照组和CRC前期患者对TCR库非优先使用的分析结果揭示了免疫库的个体差异。
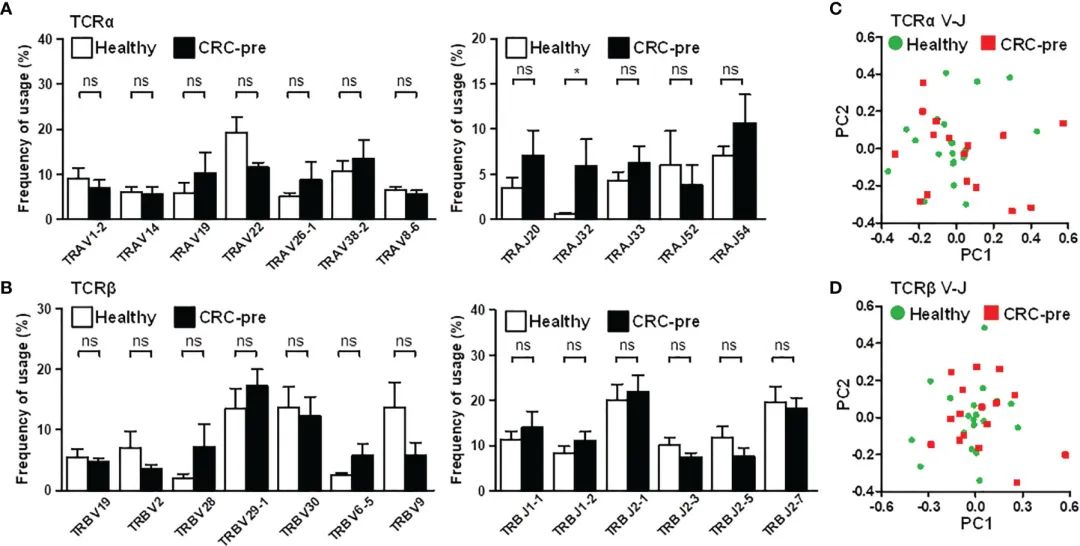
图3 TCRα和TCRβ V和J基因在结直肠癌患者和健康对照中的应用
CDR3区域核苷酸的添加和缺失表明,CDR3区域的多样性增加是由相同的基因重组引起的,这表明CDR3的差异表达可能归因于相似变量(V)和连接(J)基因的使用。基于这一假设,作者首先分析了V和J基因表达率高于5%的频率。大多数流行的V/J基因表达在健康对照组和癌症患者之间相似(图3A, B)。与健康对照组相比,CRC前期患者中TCRα的J32片段(TRAJ32)增强(图3A)。
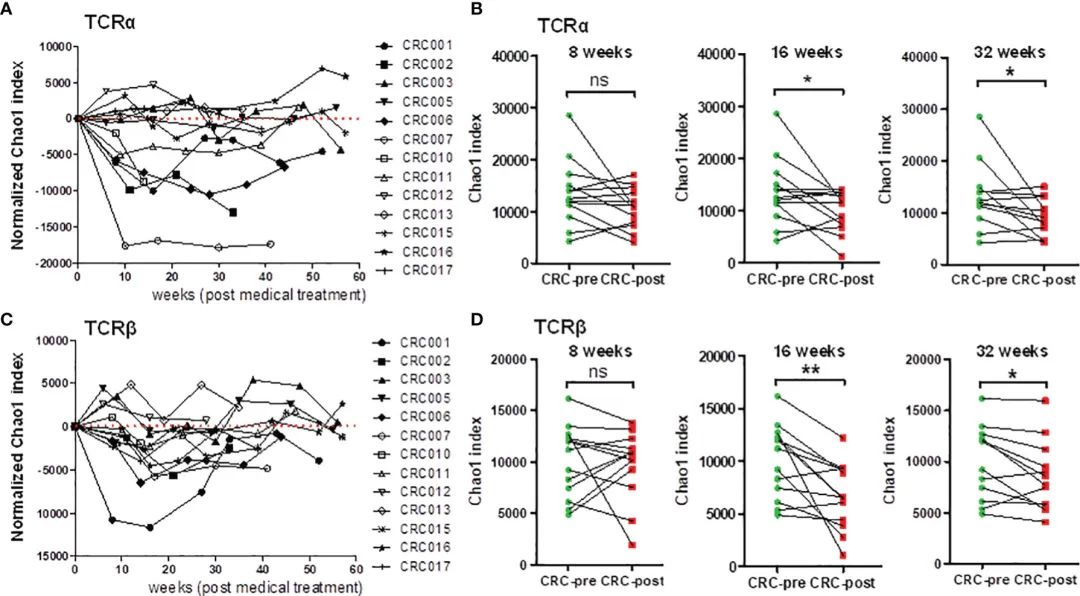
图4 随访化疗的结直肠癌患者TCRα和TCRβ库多样性动态分析。
Chao1指数用于评价结直肠癌患者化疗期间TCR多样性的动态变化。在TCRα序列中,13例随访患者中有9例的Chao1指数的时间历程图在药物治疗后呈下降趋势(图4A)。
此外,在治疗16周和32周后,CRC患者的Chao1指数与CRC前患者相比显著降低(图4B)。同样,13例患者中有9例患者在药物治疗后TCRb库中的Chao1指数下降(图4C),并且CRC患者在治疗16周和32周后与CRC前患者相比,Chao1指数明显下降(图4D)。这些结果表明,在药物治疗过程中,约69%(13例患者中有9例)的CRC患者观察到TCR库多样性显着降低。
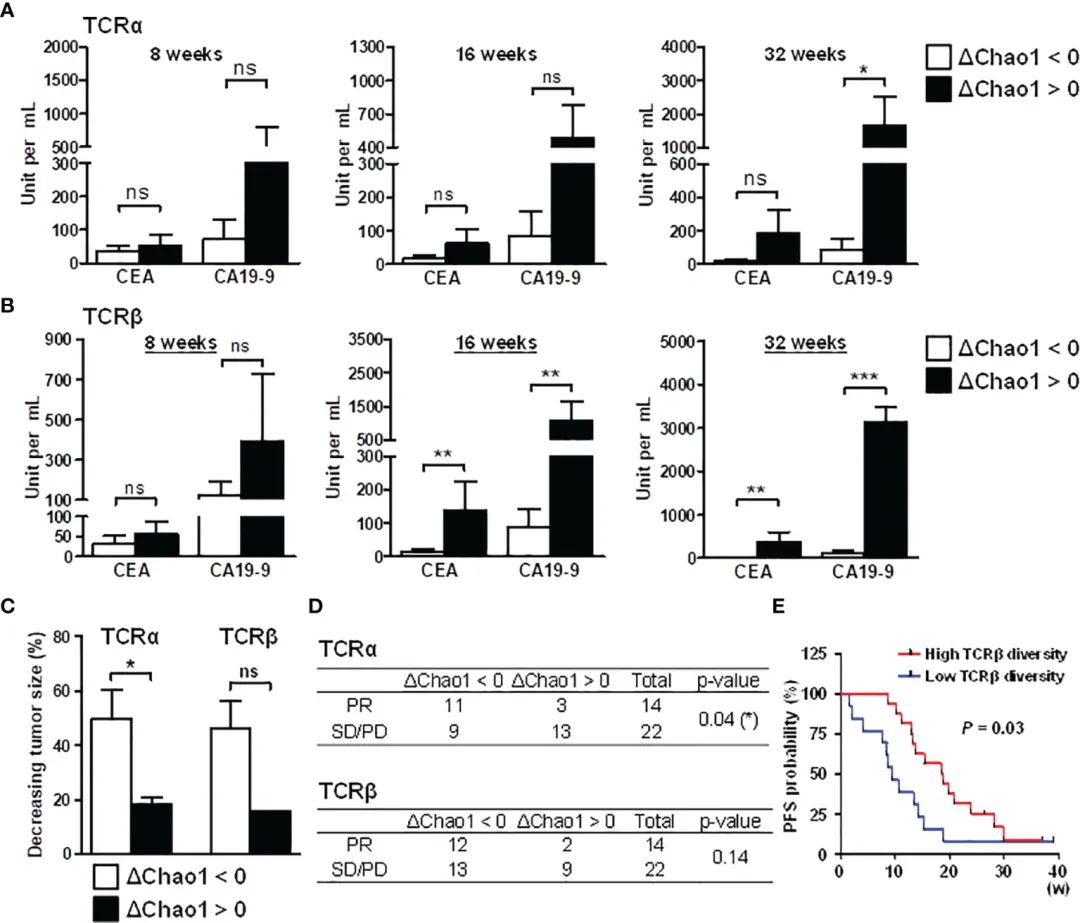
图5 CRC患者TCR库多样性降低与预后的关系。
基于化疗期间Chao1指数的动态变化,作者研究了患者TCR多样性与治疗结果的相关性。采用Chao1指数的动态变化进行分组。与基线Chao1指数相比,化疗期间Chao1指数降低的患者视为多样性降低组(DChao1 < 0);将化疗期间Chao1指数升高的患者视为多样性增加组(DChao1 > 0),比较多样性减少组(DChao1 < 0)与多样性增加组(DChao1 > 0)的相关临床参数CEA、CA19-9、肿瘤大小、白细胞计数。
在TCRa全表中,在8周、16周和32周时,DChao1 > 0组CEA和CA19-9水平有高于DChao1 < 0组的趋势(图5A)。在TCRb全组中,在16周和32周观察到这种现象(图5B)。
CEA和CA19-9水平与TCR多样性之间的相关性提示,CEA和CA19-9水平与TCR多样性之间的相关性是CRC治疗反应监测的重要依据。分析DChao1 > 0组与DChao1 < 0组之间的其他临床参数,包括嗜酸性粒细胞和嗜碱性粒细胞数量,差异无统计学意义(补充图S6A, B),特别是DChao1 > 0组的淋巴细胞和单核细胞数量分别在化疗后16周和32周较高(补充图S6A)。此外,性别也是结直肠癌死亡的一个因素(30);然而,在Chao1亚组中,男性和女性的数量几乎相当(数据未显示),这表明性别不是当前研究中的影响因素。另外,研究结果还揭示了TCR多样性在治疗过程中动态变化的意义,TCR多样性与CEA和CA19-9水平相关。
由于CT体积操作的限制,每个采集时间点的肿瘤大小无法得到适当的接收。因此,我们关注的是第三个收集时间点(治疗后平均16周),其中大多数患者接受了CT扫描以评估治疗效果。肿瘤 根据治疗16周前后肿瘤的大小测量下降率,是确定患者治疗反应的标准。在TCRa DChao1 < 0组的CRC患者的肿瘤下降率高于DChao1 > 0组的患者(图5C)
同样,尽管样本量有限,没有达到统计学意义(p = 0.07),但TCRβ谱显示出TCR多样性与肿瘤减少率之间的相关趋势(图5C)。此外,采用卡方分析来检验TCR多样性对治疗反应的动态变化。临床医生根据部分缓解(PR)、病情稳定(SD)或病情进展(PD)的临床标准评估患者的治疗反应。在TCRα库中,DChao1 < 0组CRC患者的治疗反应优于DChao1 > 0组(p = 0.04)和优势比(5.29),表明TCR多样性与治疗反应之间存在较强的相关性(图5D)。
此外,作者纳入了14例患者的额外数据,共30个样本来评估TCRβ多样性与无进展生存期(PFS)的关系,结果显示,基线时TCRβ多样性较高的患者比TCRβ多样性较低的患者具有更长的无进展生存期(PFS)(图5E)。
此外,作者应用COX回归模型分析作为PFS生物标志物的其他潜在危险因素(31),包括TCR多样性、肿瘤大小和CEA值。PFS的Cox回归分析显示,TCR多样性的风险比为0.84,表明TCR多样性每增加一个单位,风险降低15.6%(补充图S6C)。与CEA值和肿瘤大小相比,测量肿瘤患者的TCR多样性可以更好地估计疾病的生存。这一发现与TCR多样性与肿瘤恶性之间的关系是一致的(32),并揭示了TCR库在癌症治疗反应中的意义。
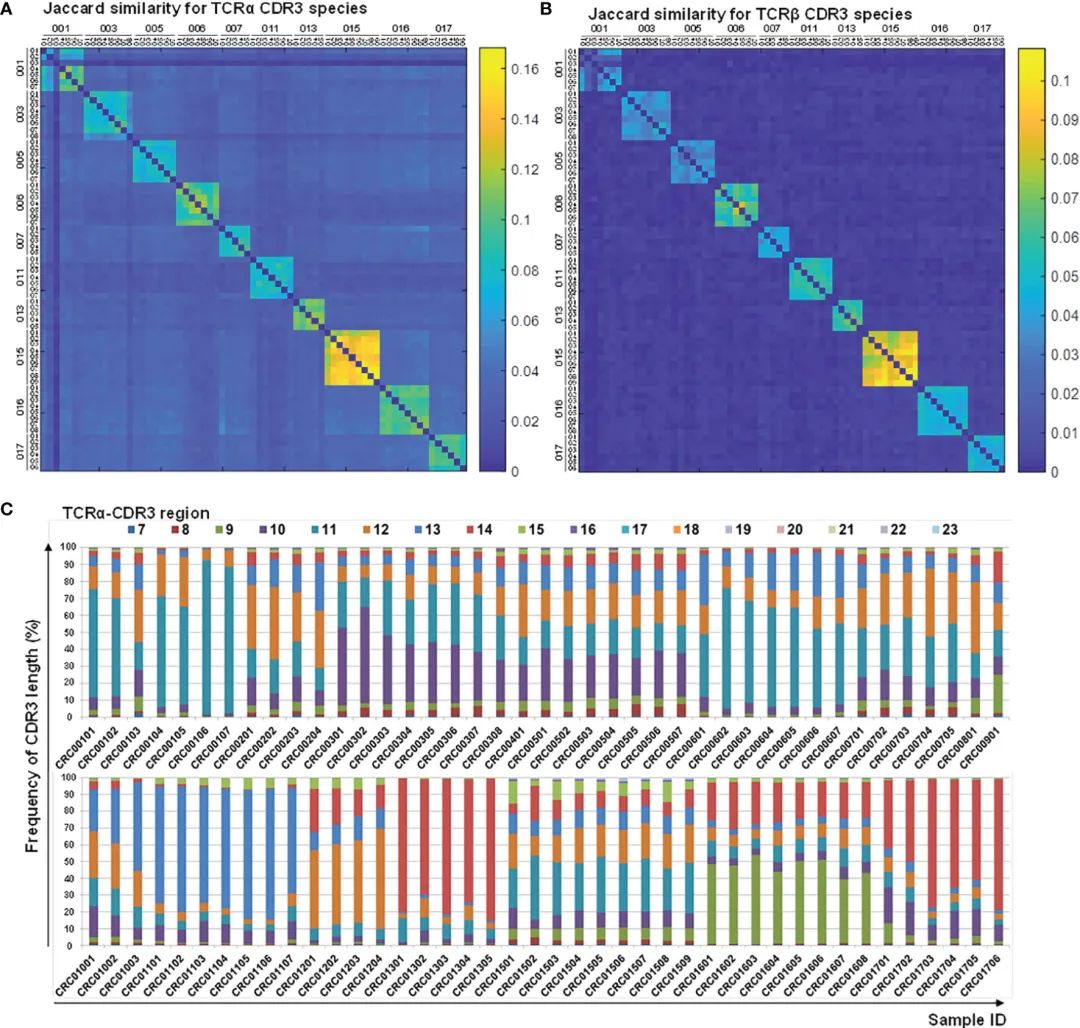
图6 治疗前后CDR3序列特征及长度分布
通过纵向TCR全库分析揭示免疫全库稳定性和个体特异性特征。
对纵向受试者(CRC-pre和CRC-post)进行相关分析,以检测治疗期间TCR库的可感知变化。CDR3基序的Jaccard指数在CRC患者之间显示出相当大的差异(图6A, B)。这表明每个病人都有不同的免疫系统。顺便提一下,CDR3肽长度的频率分布显示了CDR3基序的个体差异(图6C;补充图S7)。TCRα和TCRβ V/J基因的Pearson相关分析显示,部分患者存在部分V/J基因构型,但大多数患者存在个体V/J基因使用(补充图S8)。该分析为CRC患者缺乏公共免疫库提供了合理的解释,这支持了独特的基因重组对库多样性的影响。这些分析显示了个体TCR基因库的差异和区别,揭示了基因库测序在精准医学中的意义。
结论
这是第一个全面分析103个样本中TCRa和TCRβ库的研究,包括首次治疗和大约16个月的随访CRC受试者,使用下一代测序。研究表明,TCRα和TCRβ多样性的动态变化与治疗后肿瘤标志物(CEA和CA19-9)水平和肿瘤大小相关,这表明TCR库在监测结直肠癌治疗反应方面具有预后潜力。
此外,TCRα动力学分析显示,在作者的队列中,TCRβ变化比TCRβ变化更有效地区分患者的治疗反应。这些发现提供了可靠的方法学和观察方法,证明了mCRC患者TCR多样性降低与化疗反应相关,以及与治疗反应相关的指征,使用外周血库分析提供了有用的临床信息,扩展了对肿瘤免疫学的理解。
TCR多样性如何影响癌症患者的有效适应性免疫尚不清楚。作者目前的研究表明,基线时TCRβ多样性较高的患者比TCRβ多样性较低的患者有更好的无进展生存期。
TCRα和TCRβ VJ使用率与CDR3种类的系数分析显示,每个受试者具有独特的基因构型,配对随访样本之间的相关性高于不同个体之间的相关性。与基线TCRα多样性相比,CRC012、CRC013、CRC016和CRC017患者被归为DChao1 > 0组,化疗后治疗反应(SD/PD)较差(补充表S1),本分析中未观察到明显的TCR库变化。此外,在治疗过程中,这四种患者类型的CDR3肽长度分布趋势相似,这一结果适度支持治疗反应较差的患者没有明显的TCR库富集(图6C和补充图S7)。
与基线TCRa多样性相比,治疗后CRC001、CRC002、CRC010、CRC015患者均被归为DChao1 < 0组,且在各化疗时间点均有较好的治疗反应(PR)(补充表S1)。
随着测序技术的进步,直接测序TCRα和TCRβ基因位点可以捕捉到TCR基因库的真正多样性。目前的工作在CRC纵向队列中进行了多重PCR检测和高通量测序,提高对癌症治疗期间动态免疫反应的理解,发现Chao1指数的降低与CEA和CA19-9生物标志物水平的下降相关,而不是其他参数,包括性别、年龄和血液学特征。此外,TCR多样性成功地区分了治疗反应。因为癌症患者在初始时间点的免疫库谱表现出很大的异质性。TCR多样性是由胸腺中TCR基因片段的重组、随机插入/删除而产生的;TCR多样性有可能产生约1015 ~ 1020个TCR克隆型(34,35)。此外,每个患者中每个TCR克隆型的相对数量相对较少,而每个患者中每个TCR克隆型的相对数量相对较少,每个患者中每个TCR克隆型的相对数量相对较少,每个患者中每个TCR克隆型的相对数量相对较少。由于目前的研究是有限的,仍然需要招募另一个大型独立队列来探索个体T细胞克隆型对预测疾病生存或治疗反应的意义。
参考文献
Chen Y-T, Hsu H-C, Lee Y-S, Liu H,Tan BC-M, Chin C-Y, Chang IY-F and Yang C-Y (2022) Longitudinal High-Throughput Sequencing of the T-Cell Receptor Repertoire Reveals Dynamic Change and Prognostic Significance of Peripheral Blood TCR Diversity in Metastatic Colorectal Cancer During Chemotherapy. Front. Immunol. 12:743448. doi: 10.3389/fimmu.2021.743448

杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。
艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。

