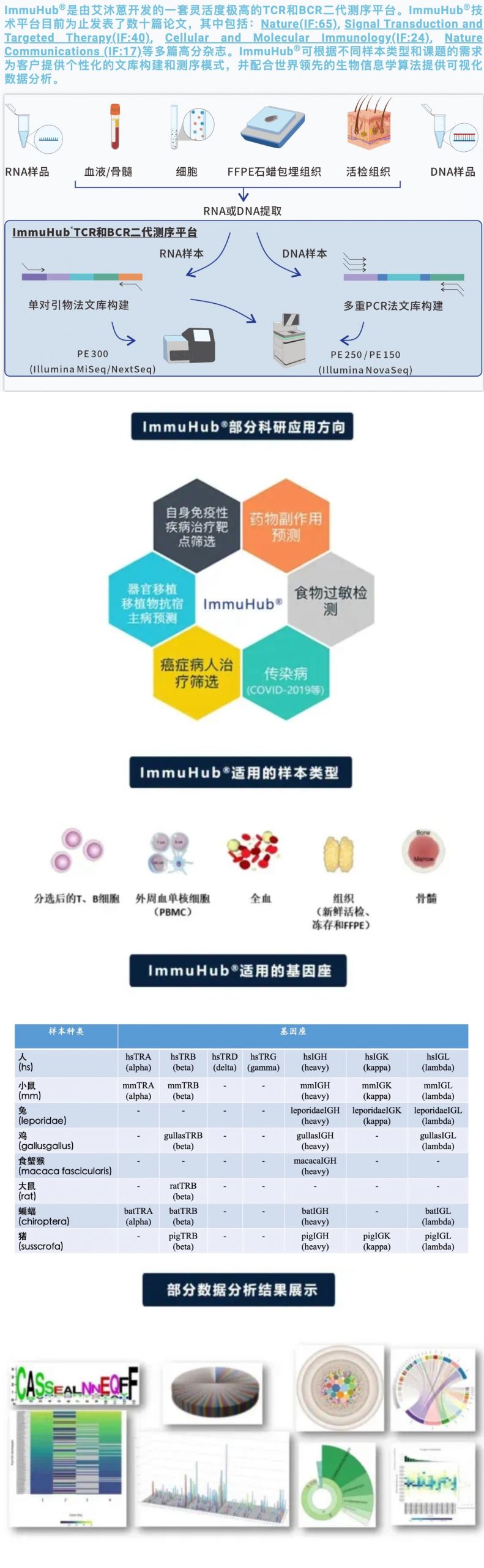
标 题:基于DNA的抗原特异性T细胞受体追踪1型糖尿病进展过程 发表时间:2023年12月 发表期刊:Science advances (IF=13.6) 研究背景 T细胞及其独特细胞受体识别主要组织相容性复合体(MHC)分子呈现的肽,在适应性免疫反应中起着至关重要的作用。T细胞受体(TCR)高度多样化是由于TCRβ链的可变(V)、多样性(D)和连接(J)片段和TCRα链的V/J片段的重组,能够识别数百万种独特的抗原。通过使用NGS测序技术,评估了给定个体中超过108个独特的α/β TCR的多样性。 1型糖尿病(T1D)是由胰岛内产生胰岛素β细胞的免疫介导破坏引起一种自身免疫性疾病。1型糖尿病(T1D)在临床症状出现之前分为不同发展阶段。T1D临床前阶段通常持续数年,其特征是外周血中存在针对胰岛素和胰腺β细胞蛋白的胰岛自身抗体,随后发展为糖耐量受损。在T1D临床前阶段监测这些胰岛抗原特异性TCR序列可能为了解疾病活动提供重要见解。 青少年糖尿病是自身免疫研究(DAISY)的一部分,作者对早期具有T1D遗传风险的儿童外周血样本中的DNA TCRβ链进行了深度测序。从这个免疫受体测序中,作者确定了流感特异性TCR和那些对胰岛素及其前胰岛素原(PPI)反应的TCR。PPI反应TCR序列来自多个T1D器官供者胰岛浸润的CD4和CD8 T细胞,44个(34%)TCRβ序列中有15个(相同的V、J和CDR3)与高危T1D个体中存在共享。这些序列与年龄/性别/人类白细胞抗原(HLA)匹配的对照组相比,在进展为T1D的患者中更常见和高频,而对照组中未发现胰岛自身抗体或糖尿病。此外,在一个单独的新发T1D患者中,TCRβ测序证实了这些PPI序列的存在。之前的研究,评估了44种PPI特异性TCR,暗示了TCR具有作为鉴定抗原特异性T细胞替代品的潜力。 研究方法 通过对处于发展为T1D风险中的个体以及年龄/性别/人类白细胞抗原匹配的对照组和一组新诊断的T1D队列的血液样本DNA 进行TCRβ测序。对1700个来自胰岛抗原或病毒反应性抗原特异性TCR序列进行了追踪。 研究结果 PART/ 01 抗原特异性TCR序列在具有遗传风险的个体和新发T1D患者的大量TCRβ链中鉴定出来
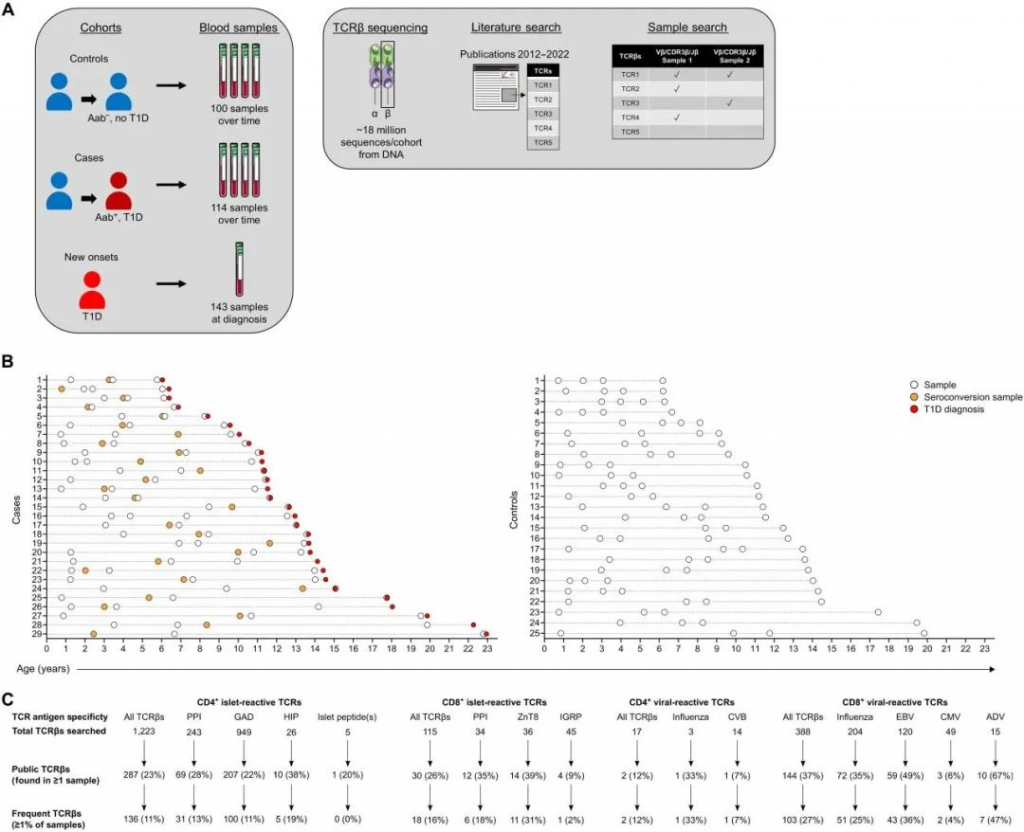
图1 为了评估儿童时期的TCR库,作者使用之前研究中的外周血DNA样本中TCRβ序列数据库,研究追踪了具有T1D遗传风险的儿童,以及另一组新发T1D患者。该TCRβ序列数据库包含超过5000万个序列,这些序列来自:(i)具有T1D遗传风险的个体,这些个体通过HLA-DR-DQ等位基因产生胰岛自身抗体和随后的临床T1D (n = 29名参与者,114个样本,称为病例组);(ii)年龄/性别/ HLA匹配的未产生胰岛自身抗体或T1D的儿童(n = 25名参与者,100份样本,称为对照组),(iii)在临床诊断时抽取一次新发T1D患者的单独队列(n = 143份样本;图1A);病例组在发展为T1D的过程中进行了四次测序,对照组的年龄与病例组相匹配,每个外周血样本同样进行了四次测序(图1B)。总体而言,所有三个队列都进行了性别、种族和HLA-DR-DQ基因型的匹配,这些基因型使T1D具有遗传风险,但组间无统计学差异,新发T1D样本的年龄与病例组和对照组的样本都匹配(表1)。从每个队列的样本中获得相似数量的TCRβ序列(表1)。在研究中,作者使用这个与临床表型相关的大型序列数据库来寻找已知的抗原特异性TCRβ序列。
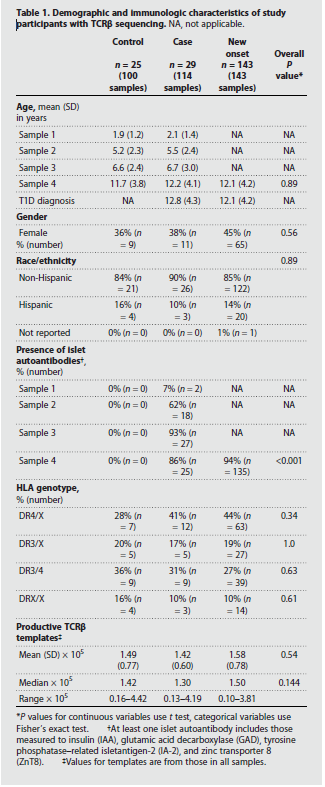
表1 从39篇文献中,共鉴定出1743个抗原特异性TCR,其中1338个具有胰岛抗原反应性序列,405个具有病毒反应性序列。胰岛抗原特异性CD4 TCR包括对前胰岛素原(PPI)、谷氨酸脱羧酶(GAD)、杂交胰岛素肽和其他胰岛肽表位有反应的TCR(图1C)。CD8 TCR的胰岛抗原特异性包括PPI、锌转运蛋白8 (ZnT8)和胰岛特异性葡萄-6-磷酸酶(IGRP)。病毒特异性主要是CD8,包括流感病毒、柯萨奇病毒B、EB病毒(EBV)、巨细胞病毒(CMV)和腺病毒(ADV)。在bulk TCRβ序列数据库中搜索这些抗原特异性TCRβ序列(相同的V, J和CDR3),该数据库包括来自三个患者队列的357个外周血样本。该外周血样本数据库大多数序列(73.5%)是独有的,在这些样本中没有共享;然而26.5%的抗原特异性序列是公开的(即至少存在于一个样本中,n = 463个序列;图1C),而其中14.9%被认为是高频的,因为至少有1%的样本(≥4个样本,n = 259个序列;图1C)。总的来说,通过从外周血TCRβ基因库中寻找胰岛和病毒抗原特异性TCR序列的方法,在具有遗传风险或患有T1D个体中发现了数百个共享和常见的抗原特异性TCRβ序列。 PART/ 02 病毒抗原特异性CD8 TCRβ序列存在于不同的队列和年龄
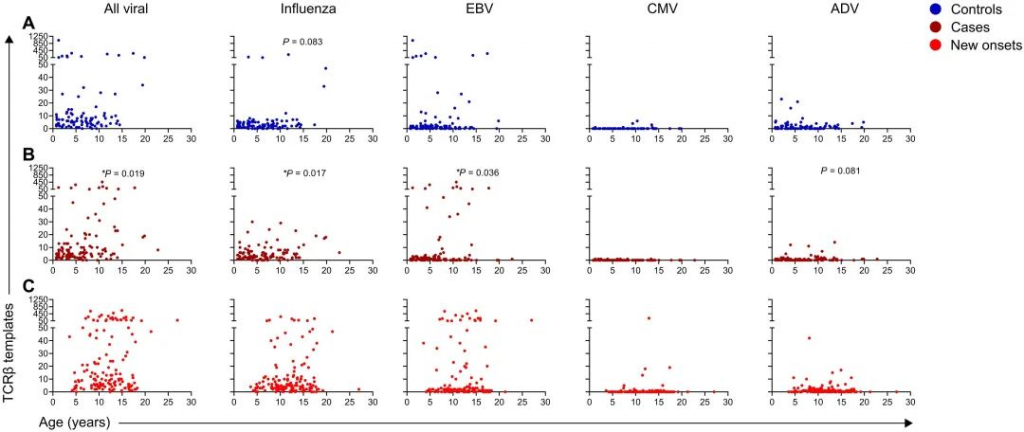
图2 在儿童和青少年时期更容易受到病毒病原体感染,由此在外周血中产生T细胞特异性。因此追踪了个体之间的病毒特异性TCRβ序列,重点关注27%(388个中的103个)CD8 TCR序列,发现这些序列是共享和高频的。在所有公开和频繁出现的病毒特异性序列(n = 105)中,TCRβ模板存在于每个队列和不同年龄(图2)。所有病毒特异性模板均随年龄增长而增加(图2)。在对照组中随着年龄的增长,CD8流感反应性TCRβ模板趋势更高(图2A)。在进展为T1D的病例中,CD8流感反应性TCRβ模板数与年龄相关(图2B)。在进展为T1D的患者中,EBV和ADV特异性TCRβ模板随着年龄的增长而增加(图2B)。尽管某些病毒特异性TCRβ模板随着年龄的增长而增加,但与具有T1D遗传风险没有相关性。在新发的T1D队列中,也存在病毒反应性TCRβ模板,特别是针对流感和EBV的TCRβ模板(图2C)。总的来说,这些结果表明,病毒反应性TCRβ序列可以很容易地在儿童和青少年的外周血中检测到。 PART/ 03 胰岛抗原特异性TCRβ序列在发展为T1D的过程中存在不同的模式
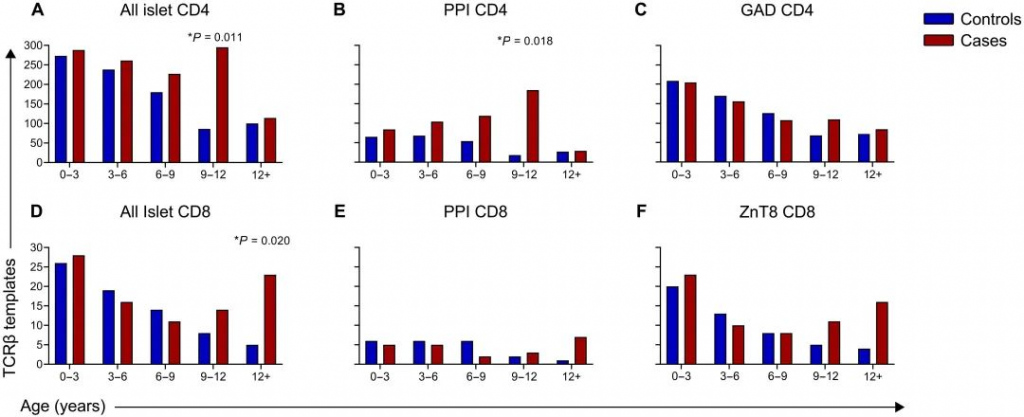
图3 接下来追踪了公共和常见的胰岛抗原特异性CD4 TCRβ序列,其中包括所有搜索到的胰岛抗原反应性TCRs 11%(1223个中的136个)。TCR识别胰岛抗原包括胰岛素及其前体、PPI、GAD、胰岛肽的混合物,以及T1D发病机制有关的翻译后修饰肽HIPs。与病毒抗原特异性TCRβs相反,胰岛抗原特异性TCRβs的存在不同的时间动态,这取决于患者队列和靶抗原。在所有胰岛抗原特异性CD4 TCRβs中,对照组和进展为临床T1D的病例在早期都有相同的模板数。然而,在对照组中模板数量随着时间的推移而稳步减少(图3A至C),而在病例组中,9至12岁年龄组的模板数量较高(图3A)。这一发现主要是由PPI特异性CD4 TCRβs驱动的,因为在对照组中模板数量减少,但在9-12岁的病例中积累(图3B)。GAD特异性CD4 TCRβ序列的模式显示,在对照组中随着年龄的增长而减少,而随着时间的推移,这些序列的模板数量更多地保持不变(图3C)。 与CD4 TCRβ序列相似,公共和常见的CD8胰岛抗原特异性TCRβ链占搜索序列的16%(115个中的18个)。这些CD8 TCR靶向的抗原包括PPI、ZnT8和IGRP。病例组和对照组在早期都有这些TCRβ序列;然而模板数量在对照组中趋于下降,在病例组中随着年龄的增长而增加(图3D至F)。在9 ~ 12岁之间,对照组和病例组之间所有胰岛CD8序列的模板数存在差异(图3D)。当通过抗原分析时间模式时,CD8 PPI TCRβs随着时间的推移在病例组中增加,而在对照组中减少,当将所有年龄段的病例与对照组进行比较时,具有统计学意义(图3E)。随着时间的推移,ZnT8特异性CD8 TCRβs在对照组中显示出模板数量减少,在9至12岁以上的病例中持续存在(图3F)。总之,这些数据表明,CD4和CD8胰岛抗原反应性TCRβ链序列在早期的T1D病例组和对照组中存在有相似的模板量,而在疾病的临床前阶段中扩展,在年龄/性别/ HLA匹配对照组中子在整个儿童时期都有收缩。 作者还在一个单独的新发T1D患者队列中按临床诊断年龄检测了胰岛抗原特异性CD4和CD8 TCRβ链序列。与临床前T1D的病例组相比,这些TCRβs在新发患者中具有更高的模板数量。CD4 PPI TCRβs序列在儿童期诊断时存在于所有年龄,而CD8 PPI序列在诊断年龄较大(>9岁)时更为突出。T1D发病时,GAD CD4 TCRβ模板数在6 – 9岁时达到峰值,而CD8 ZnT8序列呈双峰分布,在6 – 9岁时模板数最多,然后>12岁。这些数据表明,单独的T1D患者队列中存在胰岛抗原特异性TCRβ。 PART/ 04 胰岛抗原特异性TCRβ链序列与T1D疾病相关
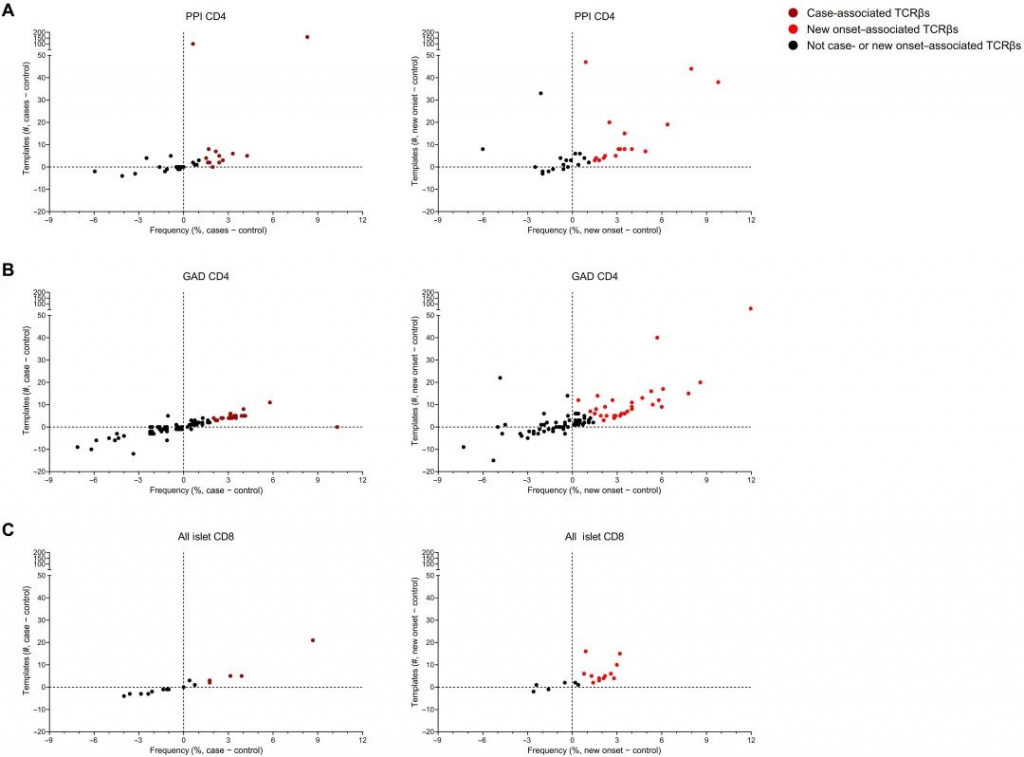
图4 虽然在所有三个队列中都发现了胰岛抗原反应性TCRβs,但作者想确定是否有TCRβ链序列与疾病相关,与对照组相比临床前疾病(病例)或新发临床T1D中以更高的频率(即样本数量)和模板数量存在。为了比较各组之间每个胰岛抗原特异性TCRβ序列的样本频率和模板数量,从病例组或新发T1D样本中减去对照组的值(图4)。如图4所示,与对照样本相比在病例或新发病样本中,几种PPI和GAD特异性CD4 TCRβs更频繁(分别为图A和B)。此外,与对照组相比这些TCRβ序列在病例和新发病病例中具有更高的模板数。与对照相比那些样本频率和/或模板数量差异最大的TCRβs被认为与疾病相关(分别图4A和B)。还发现了与疾病相关的胰岛抗原特异性CD8 TCRβs与疾病相关(图4C);然而,CD8(n=12)比CD4(n = 61)与疾病相关的TCRβs更少。一些CD4和CD8胰岛抗原特异性TCRβ链的样本频率和模板数量相似,对照组比病例组或新发病的模板数更高(图4B中的GAD特异性CD4 TCRβs);这些TCRβ序列被认为与临床前或临床T1D发病无关。 1485例患者中有1174例(79%)TCRβ序列与供体HLA-DR-DQ型匹配,从供体HLA-DR-DQ型中分离并鉴定出与疾病相关的CD4 TCR。这些数据表明,在队列中,TCRβ序列与研究参与者表达的MHC II类之间存在关系。总之,这些结果表明,与年龄/性别/ HLA匹配的对照组相比,有73个胰岛抗原TCRβ序列被认为与疾病相关,因为它们在发病前的病例组和/或临床诊断时新发T1D个体中有更高频率和模板数量存在。 PART/ 05 在T1D发展过程中,个体疾病相关的TCRβ序列存在时间变化
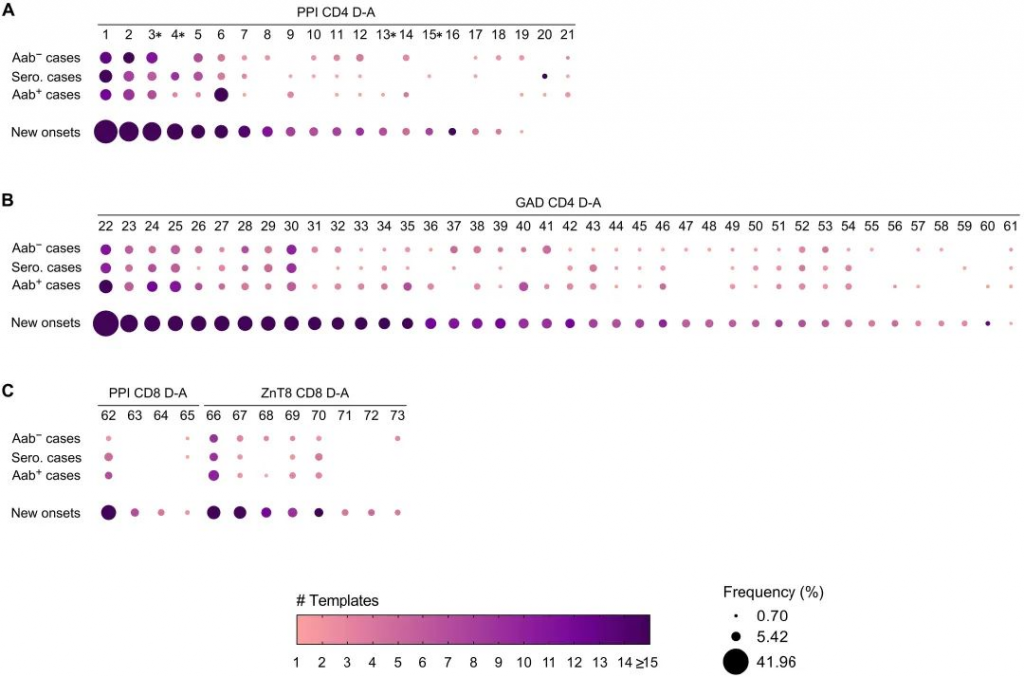
图5 病例样本按血清转化状态分为:胰岛自身抗体血清转化前(Aab−),在胰岛自身抗体血清转化时,在胰岛自身抗体阳性后(Aab+)。 新发T1D队列的结果显示在下一行。点大小表示每个疾病相关TCRβ序列在患者队列中的样本频率,而较深的颜色表示病例或新发T1D样本中TCRβ链模板数量较多。 在胰岛自身抗体血清转化之前,在血清转化时、血清转化后和临床诊断时检测TCRβ链频率(图5)。发现73个疾病相关的TCRβ链中有21个与CD4 PPI相关,有40个与GAD CD4疾病相关,11个与CD8PPI或ZnT8相关。 CD4 PPI簇研究发现,相比于临床前T1D进展期间的病例,这些样本在新发病队列中以更高的频率和模板数量存在(图5A)。GAD CD4疾病簇中,与CD4 PPI特异性序列具有相似的表达模式,因为新发病样本频率和模板数量TCRβs比疾病进展期间的病例高得多(图5B)。在疾病相关PPI或ZnT8特异性的CD8 TCRβs簇中,同样发现新发T1D队列中表达频率和模板数量更高。研究中还发现有个别序列仅已确诊TID的样本中出现,分别为PPI CD4 特异性序列(#16)、PPI CD8 特异性序列(#63和#64)、ZnT8 CD8 特异性TCRβ序列(#71和#72)。只有两个PPI TCRβs(#20和#21)出现在确诊前T1D阶段的病例中,反而在确诊病例中消失。 总的来说,在T1D确诊的患者中,疾病相关的TCRβs表达更高。因为最初筛选的TCR列表中的大多数来自对新诊断或已确诊T1D患者的TCR进行测序研究,约占三种胰岛抗原TCR序列中的两种。 PART/ 06 独特疾病相关的TCRβ序列与较早的T1D发病年龄相关
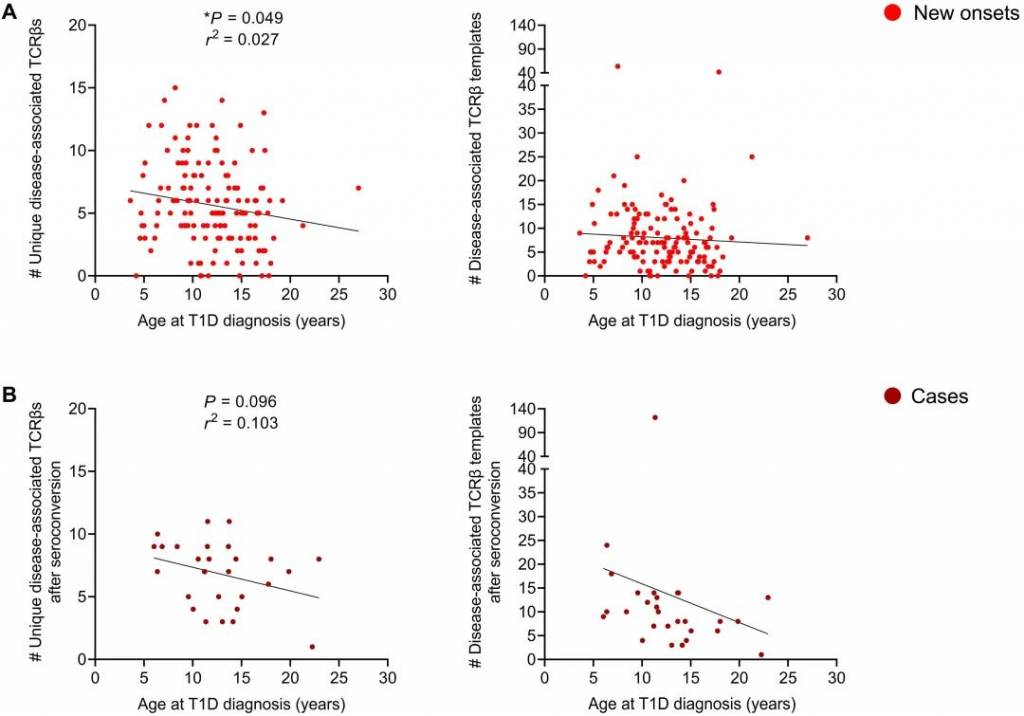
接下来,确定特定个体中与疾病相关的TCRβ序列的存在是否与临床T1D发病时的年龄有关。诊断时新发T1D病例和患者的年龄范围从儿童期到成年早期(3.6 ~ 27.0岁)。在作者的新发T1D队列中,独特疾病相关TCRβs存在较高总数(即73种疾病相关TCRβs的数量)与较早的临床T1D发病年龄相关(图6A)。同样,在病例组中疾病相关的TCRβs总表达数与临床T1D发病时的年龄存在相关性(图6B)。最后,在两个队列中,疾病相关TCRβs的模板数往往在T1D诊断时越早越高。这些发现表明,外周血中与疾病相关胰岛抗原特异性TCRβ序列的数量越多,可能与T1D临床发病的更快进展和更年轻相关。 在Ⅰ型糖尿病T1D研究中,TCRs分析至关重要,作者以T1D的儿童外周血DNA发表历年文献中汇总并统计获得1700多个抗原特异性TCRs,发现这些TCR与T1D的发生存在相关,这些TCR序列大多都是独有序列。作者在序列库研究中找寻到共享的高频TCRβ序列,发现胰岛抗原特异性TCRβ链相比,共享序列存在较多的病毒特异性(分别为27%和12%),并且部分序列呈现高度扩增的现象。当儿童暴露于或感染流感、EBV和CMV等常见病毒时,T细胞会发生扩增。相比之下,在临床T1D进展过程中,当前对胰岛抗原特异性TCR库的深度分析相对较少。本研究发现,在T1D确诊的患者中,疾病相关TCRβs表达更高。同时发现在治疗前后T1D相关TCRβ的DNA存在73个胰岛抗原特征性序列,这些序列有望成为这些治疗反应的潜在生物标志物。 综上所述,胰岛抗原特异性和疾病相关TCR,可以用于T1D进展跟踪,表明这些TCR具有帮助T1D预防和疾病进展监测的潜力。同时作者还提供了一个新策略,在针对抗原特异性T细胞进行治疗前后,监测各种自身免疫性疾病中与疾病相关的TCR,可能具有更好的监测效果。 艾沐蒽生物开发的TCR/BCR ImmuHub®测序平台,分别针对DNA和RNA开发了一套检测产品,通过多重PCR或RACE的方法进行扩展和建库,其中RNA+5’RACE建库方法引入UMBI(Unique Molecular Barcoded Index,独立分子条形码)进行文库构建。这可对后续PCR扩增或测序过程中的错误进行有效纠正,还原真实的数据,有效杜绝PCR扩增错误和测序错误,从而提高结果准确率。可以为Ⅰ型糖尿病T1D在TCR方面的研究提供更多帮助。 参考文献Mitchell AM, Baschal EE, McDaniel KA, Fleury T, Choi H, Pyle L, Yu L, Rewers MJ, Nakayama M, Michels AW. Tracking DNA-based antigen-specific T cell receptors during progression to type 1 diabetes. Sci Adv. 2023 Dec 8;9(49):eadj6975. doi: 10.1126/sciadv.adj6975. Epub 2023 Dec 8. PMID: 38064552; PMCID: PMC10708189.图6