

еПСи°®дЇОJournal of Allergy and Clinical ImmunologyжЭВењЧзЪДдЄАзѓЗжЦЗзЂ†иѓБжШОдЇЖдЄ•йЗНиБФеРИеЕНзЦЂзЉЇйЩЈпЉИSCIDпЉЙжВ£иАЕзІїж§НеРОзЪДTCR ќ≤еЇУзЪДе§Ъж†ЈжАІеЈЃеИЩйҐДз§ЇзЭАеЕНзЦЂйЗН忯姱賕пЉМеПѓиГљйЬАи¶БдЇМжђ°еє≤йҐДгАВ



еПСи°®жЧґйЧіпЉЪ2022еєі3жЬИ
ељ±еУНеЫ†е≠РпЉЪ14.2
з†Фз©ґжЦєж≥ХпЉЪжЬЙ31еРНжО•еПЧйА†и°АзїЖиГЮзІїж§НпЉИHCTпЉЙпЉИn=28пЉЙжИЦеЯЇеЫ†ж≤їзЦЧпЉИGTпЉЙпЉИn=3пЉЙдљЬдЄЇдЄАзЇњжЬАзїИж≤їзЦЧзЪДSCIDеДњзЂ•зЇ≥еЕ•з†Фз©ґгАВеИЖеИЂеЬ®HCTдєЛеЙНеТМHCTеРО3дЄ™жЬИгАБ6дЄ™жЬИгАБ12дЄ™жЬИеПКжѓПеєіж≤їзЦЧеРОйЗЗйЫЖе§ЦеС®и°Аж†ЈжЬђпЉМжЬАйХњиЊЊ4еєіпЉМжПРеПЦRNAпЉМдљњзФ®5`RACE+UMIпЉИзЛђзЙєеИЖе≠Ржݰ嚥з†БпЉЙжКАжЬѓињЫи°МTCR ќ≤йУЊдЇМдї£жµЛеЇПгАВ


еЫЊ1
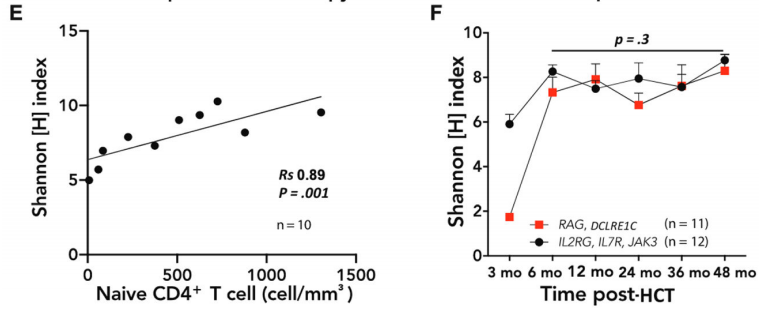
йАЪињЗShannon[H]еТМSimpson[1-D]жМЗжХ∞жµЛйЗПиІВеѓЯеИ∞еЬ®зїЖиГЮж≤їзЦЧеРО3дЄ™жЬИжЧґеЇУе§Ъж†ЈжАІдЄ•йЗНеПЧйЩРпЉМеЬ®6дЄ™жЬИжЧґжШЊиСЧжФєеЦДпЉМе§Ъж†ЈжАІеҐЮеК†пЉИP<0.01пЉЙпЉИеЫЊ1A-CпЉЙ.
еЬ®жЙАжЬЙжО•еПЧHCTзЪДжВ£иАЕдЄ≠пЉМ3дЄ™жЬИжЧґShannon[H]жМЗжХ∞вЙ§5.2зЪДжВ£иАЕ襀聧䪯йЬАи¶БињЫи°МзђђдЇМжђ°еє≤йҐДпЉИеЉВдљУHCTжИЦGT)пЉМељУйЬАи¶БзђђдЇМжђ°еє≤йҐДжЧґпЉМHCT襀聧䪯жШѓдЄНжИРеКЯзЪДгАВдЄОдЄНжИРеКЯзЪДHCTзЫЄжѓФпЉМжИРеКЯHCTеРОзЪДе§Ъж†ЈжАІжФєеЦДжЫіењЂпЉИеЫЊ1DпЉЙгАВ
еЫЊ1
еЬ®ж≤їзЦЧеРО6дЄ™жЬИпЉМHжМЗжХ∞дЄОеИЭеІЛCD4+TзїЖиГЮжАїжХ∞жШЊиСЧзЫЄеЕ≥пЉИRs = 0.89пЉЫP=0.001пЉЙпЉИеЫЊ1EпЉЙпЉМTзїЖиГЮжШѓйҐДжµЛеЕНзЦЂйЗНеїЇиі®йЗПзЪДзФЯзЙ©ж†ЗењЧзЙ©гАВ
еЫЊ1FеПНжШ†дЇЖеЯЇеЫ†еЮЛдЄОHCTеРОеЕНзЦЂйЗНеїЇзЪДеЕ≥з≥їгАВ12еРНе≠ШеЬ®IL2RGгАБIL7RеТМJAK3еЯЇеЫ†зЉЇйЩЈзЪДжВ£иАЕдЄО11еРНе≠ШеЬ®RAGеТМDCLRE1CеЯЇеЫ†зЉЇйЩЈзЪДжВ£иАЕзЫЄжѓФпЉМTCRе§Ъж†ЈжАІзЪДеПСе±ХеК®еКЫе≠¶зЫЄдЉЉпЉИRAG/DCLRE1CзїДеЬ®3дЄ™жЬИзЪДжЧґйЧізВєдїЕжЬЙ1дЄ™ж†ЈжЬђпЉМдЄНиґ≥дї•иѓДдЉ∞дЄ§зїДдєЛйЧізЪДеЈЃеЉВжШѓеР¶жШЊиСЧпЉЙгАВ
еЫЊ2
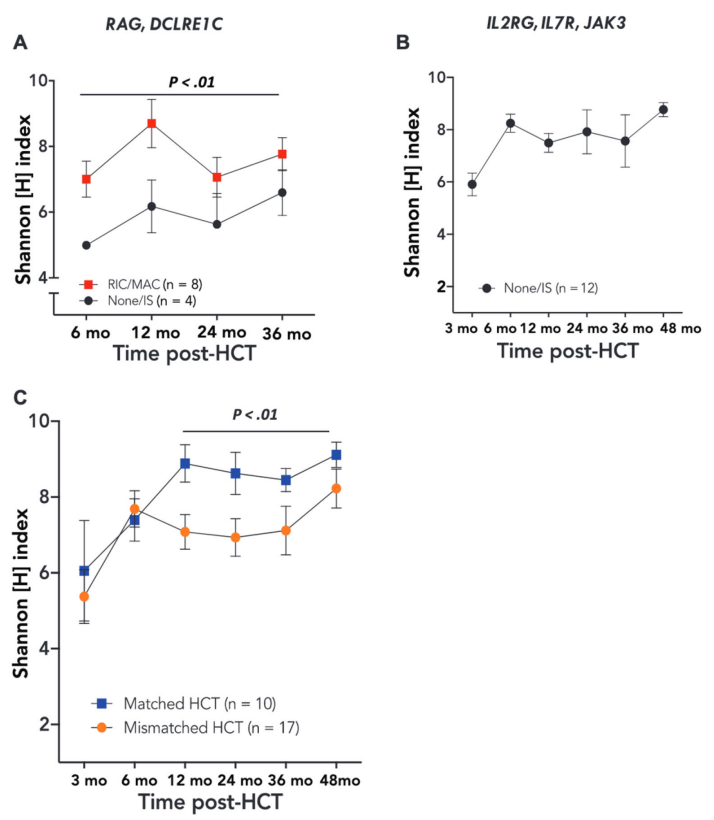
еЬ®RAG/DCLRE1CзїДдЄ≠пЉМжЧ†йҐДе§ДзРЖжИЦеЕНзЦЂжКСеИґпЉИimmune suppressionпЉЙзЪДHCTзЪДе§Ъж†ЈжАІжМБзї≠дљОдЇОжЄЕйЂУжАІпЉИMACпЉЙжИЦдљОеЉЇеЇ¶пЉИRICпЉЙйҐДе§ДзРЖзЪДHCTпЉИP <0.01пЉЙпЉИеЫЊ2AпЉЙпЉЫиАМеЬ®IL2RG/IL7R/JAK3зїДдЄ≠пЉМжО•еПЧHCTеЕНзЦЂжКСеИґзЪД12еРНжВ£иАЕеЭЗиЊЊеИ∞ж≠£еЄЄзЪДе§Ъж†ЈжАІпЉИеЫЊ2BпЉЙгАВ
дїОHCTеРО12дЄ™жЬИеЉАеІЛпЉМжЭ•иЗ™еМєйЕНдЊЫдљУзЪДHCTжѓФжЭ•иЗ™дЄНеМєйЕНдЊЫдљУзЪДHCTеЕЈжЬЙжЫійЂШзЪДTCRе§Ъж†ЈжАІпЉИP=0.01пЉЙпЉИеЫЊ2CпЉЙгАВ
еЫЊ3
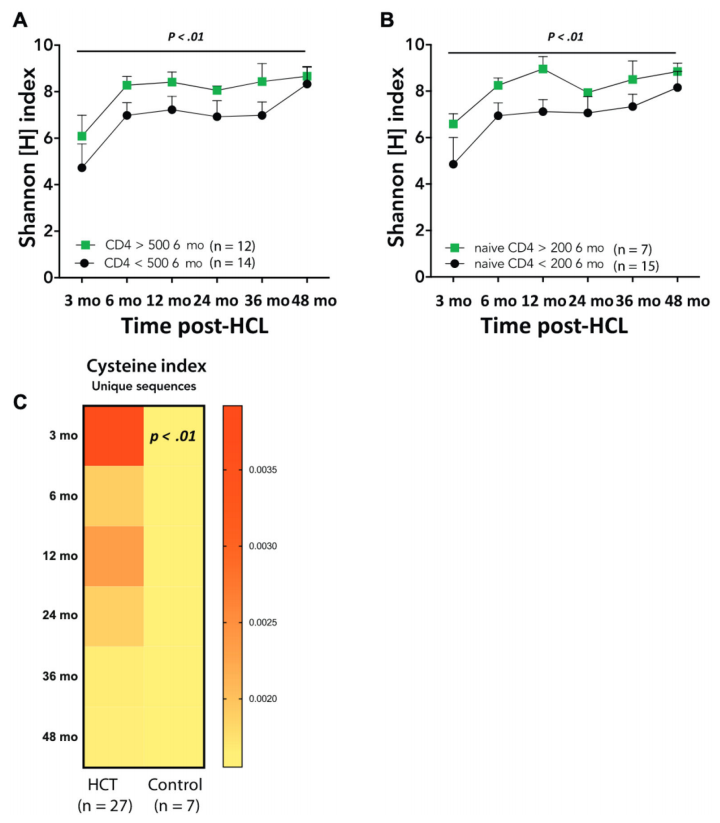
HCTеРО6дЄ™жЬИзЪДCD4+TзїЖиГЮиЃ°жХ∞иґЕињЗ500дЄ™/mm3жИЦеИЭеІЛCD4+TзїЖиГЮиЃ°жХ∞иґЕињЗ200дЄ™/mm3дЄОHCTеРО24еТМ36дЄ™жЬИжЫійЂШзЪДTRBе§Ъж†ЈжАІзЫЄеЕ≥пЉИP <0.01пЉЙпЉИеЫЊ3AгАБBпЉЙпЉМиѓіжШОHCTжЬѓеРО6дЄ™жЬИзЪДCD4+TзїЖиГЮиЃ°жХ∞еПѓйҐДжµЛжМБзї≠зЪДеЕНзЦЂйЗНеїЇгАВ
дЄО7дЊЛеБ•еЇЈеДњзЂ•зЫЄжѓФпЉМжЙАжЬЙ27дЊЛSCIDжВ£иАЕеЬ®HCTеРО3дЄ™жЬИзЪДTRBеЇПеИЧеѓМеРЂCDR3й°ґзЂѓеРЂжЬЙеНКиГ±ж∞®йЕЄжЃЛеЯЇзЪДзЛђзЙєreadsвАФвАФињЩжШѓдЄАзІНиЗ™жИСеПНеЇФжАІзЪДзФЯзЙ©ж†ЗењЧзЙ©пЉИеЫЊ3CпЉЙгАВеЬ®SCIDж≤їзЦЧеРОзЪДжЧ©жЬЯTзїЖиГЮеЇУдЄ≠пЉМињЩзІНеИЖе≠РзЙєеЊБзЪДеЗЇзО∞еПѓиГљжЬЙеК©дЇОиІ£йЗКеЬ®ињЩдЇЫжВ£иАЕдЄ≠еПСзФЯиЗ™иЇЂеЕНзЦЂжАІзЦЊзЧЕзЪДй£ОйЩ©жЫійЂШгАВ






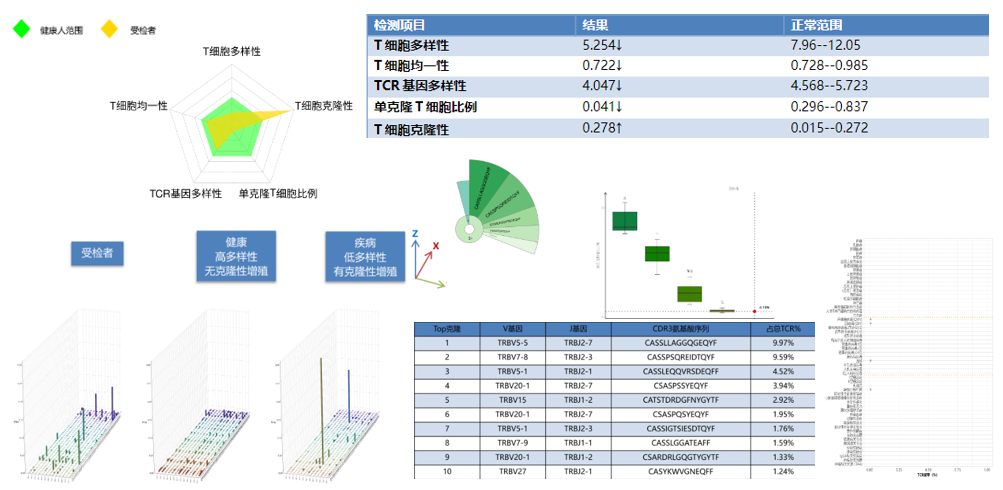
HSCTжВ£иАЕImmun-Cheq¬Ѓж£АжµЛжК•еСКеЫЊз§Ї


пЉИ2пЉЙж†ЈжЬђи¶Бж±ВпЉЪ
5mlеЈ¶еП≥и°Ажґ≤ж†ЈжЬђпЉИEDTAжКЧеЗЭзЃ°пЉЙпЉМ 4¬∞C ињРиЊУпЉМ24-48hеЖЕйАБиЊЊгАВ
пЉИ3пЉЙж£АжµЛеС®жЬЯпЉЪ
жФґеИ∞ж†ЈжЬђеРОпЉМ15дЄ™еЈ•дљЬжЧ•еЖЕеЗЇеЕЈзїУжЮЬжК•еСКгАВ
搥ињОжЙЂжППдЄЛжЦєдЇМзїіз†БжЈїеК†пЉМиБФз≥їеҮ胥иЙЊж≤РиТљдЇІеУБзїПзРЖпЉЪдљЩиАБеЄИ

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљеЖЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂеЯЇеЫ†зїДе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДйЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃзЦЊзЧЕжЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TиНѓзЙ©еЉАеПСз≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВ
иЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


