
ж†З йҐШпЉЪжґ≤дљУжіїж£АдЄ≠cfDNAзЪДйБЧдЉ†еЫЊи∞±пЉЪBзїЖиГЮжЈЛеЈізШ§иѓКжЦ≠еТМеПѓжµЛйЗПжЃЛзХЩзЧЕзЫСжµЛзЪДи°•еЕЕеЈ•еЕЈ еПСи°®жЧ•жЬЯпЉЪ2023еєі8жЬИ еПСи°®жЬЯеИКпЉЪCancers з†Фз©ґиГМжЩѓ з†Фз©ґжЦєж≥Х жЬђз†Фз©ґзЇ≥еЕ•78еРНе§ІBжЈЛеЈізШ§пЉИlarge B-cell lymphoma,LBCLпЉЙжИЦжї§ж≥°жЈЛеЈізШ§пЉИfollicular lymphoma,FLпЉЙжВ£иАЕпЉМз†Фз©ґйАЪињЗNGSеѓє59дЄ™иѓКжЦ≠жЧґзїДзїЗж†ЈжЬђзЪДgDNAеТМ70дЄ™ж≤їзЦЧеЙНи°АжµЖж†ЈжЬђзЪДcfDNAпЉМдї•еПК78еРНжВ£иАЕеЬ®дЄНеРМжЧґйЧізВєпЉИж≤їзЦЧдЄ§дЄ™еС®жЬЯеРОгАБж≤їзЦЧзїУжЭЯжЧґ(EOT)гАБж≤їзЦЧеРОйЪПиЃњгАБжИЦињЫе±ХжИЦе§НеПСжЧґпЉЙзЪДи°АжµЖж†ЈжЬђињЫи°МжµЛеЇПеИЖжЮРпЉМеЊЧеИ∞зїДзїЗж†ЈжЬђеТМи°АжµЖж†ЈжЬђзЪДз™БеПШзОЗеПКPET/CTзїУжЮЬдЄОLiqBio-MRDзїУжЮЬдєЛйЧізЪДзЫЄеЕ≥жАІгАВ и°АжµЖж†ЈжЬђ(cfDNA)еТМзїДзїЗж†ЈжЬђ(gDNA)еЯЇзЇњеЯЇеЫ†еИЖеЮЛ з†Фз©ґйАЪињЗNGSжµЛеЇПжКАжЬѓеИЖжЮРдЇЖ59дЄ™зїДзїЗж†ЈжЬђзЪДgDNAдї•еПК70дЄ™и°АжµЖж†ЈжЬђзЪДcfDNAпЉМзїУжЮЬеПСзО∞gDNAж†ЈеУБз™БеПШзОЗдЄЇ95%пЉМcfDNAж†ЈеУБз™БеПШзОЗдЄЇ71%гАВз†Фз©ґеПСзО∞еЬ®73%(16/22)зЪДи°АжµЖж†ЈжЬђдЄ≠иѓЖеИЂеИ∞зїДзїЗж†ЈжЬђжЬ™иѓЖеИЂеИ∞MRDзЪДжФєеПШпЉМзїУжЮЬи°®жШОзїДзїЗжіїж£АдЄ≠еПСзО∞зЪДз™БеПШжХ∞йЗПжШѓеЬ®и°АжµЖдЄ≠еПСзО∞зЪДз™БеПШжХ∞йЗПзЪДдЄ§еАНпЉМеПѓдї•зЫСжµЛеИ∞зїДзїЗж†ЈжЬђж£АжµЛдЄНеИ∞зЪДMRDгАВ дЄЇдЇЖиѓДдЉ∞LBCLеТМFLдєЛйЧізЪДеЯЇеЫ†зїДеЈЃеЉВпЉМз†Фз©ґжѓФиЊГдЇЖеЬ®дЄНеРМзЧЕзРЖдЇЪеЮЛдЄ≠еПСзО∞зЪДдљУзїЖиГЮз™БеПШгАВLBCLзїДзїЗеТМи°Ажґ≤ж†ЈжЬђдЄ≠жЬАеЄЄеПСзФЯз™БеПШзЪДеЯЇеЫ†жШѓ:KMT2DгАБTP53гАБMYD88гАБCARD11гАБCREBBPгАБBCL2гАВзЙєеИЂжШѓCARD11еТМKMT2DеЬ®зФЯеПСдЄ≠ењГ(germinal center,GC)и°®еЮЛдЄ≠еН†дЄїеѓЉеЬ∞дљНпЉМиАМMYD88гАБPIM1еТМCD79BеЬ®йЭЮGCи°®еЮЛдЄ≠еН†дЄїеѓЉеЬ∞дљНпЉМеЬ®FLдЄ≠пЉМжЬАеЄЄиІБзЪДз™БеПШеЯЇеЫ†жШѓKMT2DгАБCREBBPгАБBCL2еТМEZH2гАВзїУжЮЬеПСзО∞LBCLйЕНеѓєи°Ажґ≤еТМзїДзїЗж†ЈжЬђдЄ≠йЙіеЃЪзЪДдљУзїЖиГЮз™БеПШVAFзЪДзЫЄеЕ≥жАІйЂШдЇОFLгАВ
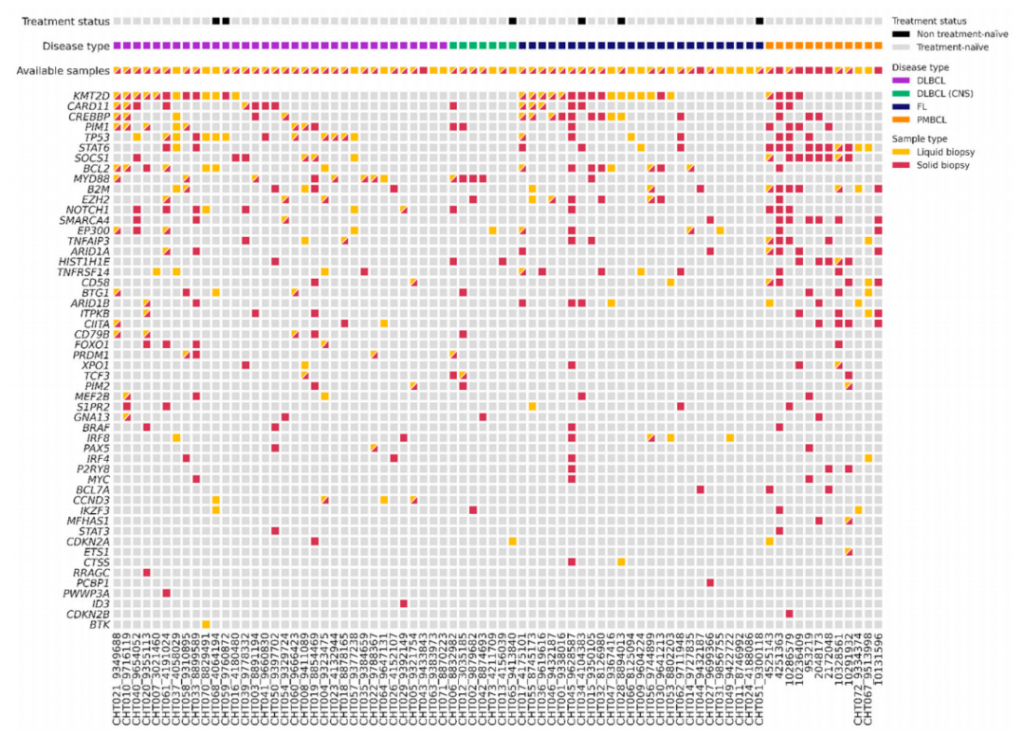
з†Фз©ґзїУжЮЬињШз°ЃеЃЪдЇЖ56дЄ™дЄОжЈЛеЈізШ§еПСзФЯзЫЄеЕ≥зЪДеЯЇеЫ†пЉМдїОиАМз°ЃеЃЪдЇЖBзїЖиГЮжЈЛеЈізШ§еЬ®иѓКжЦ≠жЧґзЪДз™БеПШи∞± PET/CTдЄОLiqBio-MRDзЪДзЫЄеЕ≥жАІ 78еРНжВ£иАЕдЄ≠жЬЙ36дЊЛеРМжЧґжЬЙPET/CTеТМcfDNAж†ЈжЬђпЉМз†Фз©ґеЫҐйШЯж†єжНЃPET/CTзїУжЮЬпЉМе∞ЖињЩ36еРНжВ£иАЕеИЖдЄЇдЄ§зїД:(1)йШіжАІзїДпЉМеМЕжЛђеЃМеЕ®зЉУиІ£зЪДжВ£иАЕ (2)йШ≥жАІзїДпЉМеМЕжЛђйГ®еИЖдї£и∞ҐеПНеЇФжВ£иАЕеТМињЫи°МжАІзЦЊзЧЕжВ£иАЕгАВзїУжЮЬеПСзО∞PET/CTеТМLiqBio-MRDзЪДдЄАиЗіжАІиЊЊеИ∞83%пЉМеП™жЬЙ6дЊЛж†ЈжЬђеЗЇзО∞дЄНдЄАиЗізїУжЮЬпЉМеЕґдЄ≠4дЊЛжВ£иАЕPET/CTйШ≥жАІпЉМLiqBio-MRDйШіжАІпЉЫ2дЊЛPET/CTйШіжАІгАБLiqBio-MRDйШ≥жАІгАВз†Фз©ґеПСзО∞ињЩдЇЫзЧЕдЊЛжЬЙдЄ§дЄ™еЕ±еРМзЪДзЙєзВє:(1)зФ±дЇОTP53з™БеПШпЉМдїЦдїђзЪДLiqBio-MRDеСИйШ≥жАІ(2)дїЦдїђеЬ®жЈЛеЈізШ§иѓКжЦ≠дєЛеЙНжИЦдєЛеРОйГљжЬЙдЄКзЪЃзЩМзЪДзЧЕеП≤гАВдїОзїУжЮЬжЭ•зЬЛпЉМLiqBio-MRDзЪДжХПжДЯжАІиЊГPET/CTдљОпЉМдљЖзЙєеЉВжАІиЊГPET/CTйЂШгАВ
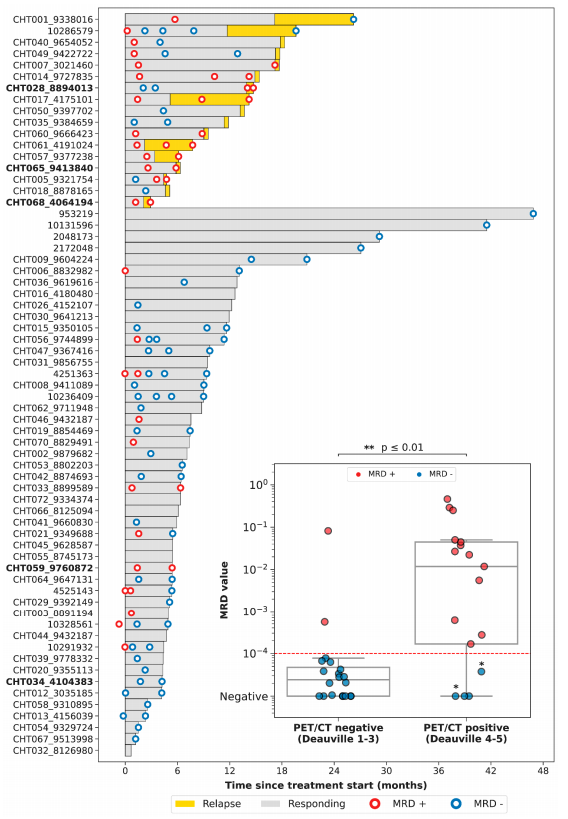
1 и°АжµЖcfDNAдЄОзїДзїЗж†ЈжЬђиБФеРИдљњзФ®дЉШдЇОеНХдљњзФ®зїДзїЗж†ЈжЬђпЉЪз†Фз©ґйАЪињЗеѓєи°АжµЖзЪДcfDNAеТМзїДзїЗж†ЈжЬђзЪДgDNAињЫи°МжµЛеЇПпЉМиѓБжШОдЇЖе∞љзЃ°еЬ®зїДзїЗжіїж£АдЄ≠еПСзО∞зЪДз™БеПШжХ∞йЗПжШѓеЬ®и°АжµЖдЄ≠еПСзО∞зЪДз™БеПШжХ∞йЗПзЪДдЄ§еАНпЉМдљЖдљУжґ≤жіїж£АдЄ≠и°АжµЖcfDNAеПѓдї•иѓЖеИЂзїДзїЗжіїж£АдЄ≠еПѓиГљж£АжµЛдЄНеИ∞зЪДз™БеПШпЉМеЫ†ж≠§пЉМи°АжµЖcfDNAдЄНиГљжЫњдї£зїДзїЗжіїж£АпЉМдљЖеЬ®иѓКжЦ≠жЧґеПѓдљЬдЄЇBCLеЯЇеЫ†еИЖеЮЛзЪДи°•еЕЕжЭ•жЇРгАВ 2 LiqBio-MRDдЄОPET/CTжЦєж≥ХзЫЄжѓФпЉЪеПСзО∞LiqBio-MRDзЪДжХПжДЯжАІиЊГдљОпЉМдљЖзЙєеЉВжАІиЊГйЂШгАВеЬ®EOTеПНеЇФиѓДдЉ∞еТМйЪПиЃњдЄ≠зїУеРИињЩдЄ§зІНжКАжЬѓе∞ЖжЫіеЗЖз°ЃеЬ∞дЇЖиІ£жВ£иАЕзЪДеЃЮйЩЕжГЕеЖµпЉМеєґжЬЙеИ©дЇОжВ£иАЕжЬ™жЭ•зЪДзЉУиІ£гАВ 3 иѓ•з†Фз©ґзЭАйЗНеИЖжЮРдљУжґ≤жіїж£Аи°АжµЖдЄ≠cfDNA-MRDзїУжЮЬпЉМзЉЇе∞СеѓєTCR/BCRзЪДз†Фз©ґгАВTCRеТМIGеЯЇеЫ†еЃґжЧПзЪДеНХеЕЛйЪЖйЗНжОТжШѓжЈЛеЈізШ§зїЖиГЮзЊ§зЪДйЗНи¶БзЙєеЊБпЉМIG еТМ TCR еЯЇеЫ†йЗНжОТдљЬдЄЇж£АжµЛжЈЛеЈізїЖиГЮеЕЛйЪЖжАІеҐЮзФЯзЪДйЗСж†ЗеЗЖпЉМзЫЃеЙНеЫљеЖЕе§Це§ЪдЄ™з†Фз©ґзїУжЮЬеТМжЈЛеЈізШ§иѓКжЦ≠жМЗеНЧиВѓеЃЪдЇЖNGS IG/TCR еЕЛйЪЖжАІж£АжµЛеТМMRDзЫСжµЛзЪДдЄіеЇКжМЗеѓЉжДПдєЙгАВиЙЊж≤РиТљиЗ™дЄїз†ФеПСзЪДSeq-MRD¬ЃеЯЇдЇОеЕНзЦЂзїДпЉИIG/TCRпЉЙNGSжКАжЬѓпЉМзїУеРИзФЯзЙ©дњ°жБѓе≠¶еИЖжЮРпЉМеПѓеЗЖз°ЃжЯ•жЙЊзЩМзїЖиГЮеЕЛйЪЖеЇПеИЧпЉМйЂШзБµжХПеЬ∞ињљиЄ™ж£АжµЛMRDж∞іеє≥пЉМеЄЃеК©BзїЖиГЮжЈЛеЈізШ§жВ£иАЕйҐДжµЛйХњжЬЯзЦЧжХИгАБиѓДдЉ∞ж≤їзЦЧжХИжЮЬгАБзЫСжµЛзЉУиІ£зКґжАБдї•еПКж£АжµЛжЧ©жЬЯе§НеПСгАВ
еПВиАГжЦЗзМЃпЉЪFigaredo G, Mart√≠n-Mu√±oz A, Barrio S, Parrilla L, Campos-Mart√≠n Y, Poza M, Rufi√°n L, Algara P, De La Torre M, Jim√©nez Ubieto A, Mart√≠nez-L√≥pez J, Casado LF, Mollejo M. Genetic Profiling of Cell-Free DNA in Liquid Biopsies: A Complementary Tool for the Diagnosis of B-Cell Lymphomas and the Surveillance of Measurable Residual Disease. Cancers (Basel). 2023 Aug 8;15(16):4022. doi: 10.3390/cancers15164022. PMID: 37627050; PMCID: PMC10452485.

еПСи°®зЫЄеЕ≥жЦЗзМЃ Seq-MRD¬ЃеПСи°®зЫЄеЕ≥жЦЗзМЃ 1гАБHuang Y, Zhao H, Shao M, Zhou L, Li X, Wei G, Wu W, Cui J, Chang AH, Sun T, Hu Y, Huang H.¬†Predictive value of next-generation sequencing-based minimal residual disease after CAR-T cell therapy.¬†Bone Marrow Transplant.¬†2022 Jun 1. doi: 10.1038/s41409-022-01699-2. Epub ahead of print. PMID: 35650329.пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

2гАБChen H, Gu M, Liang J, Song H, Zhang J, Xu W, Zhao F, Shen D, Shen H, Liao C, Tang Y, Xu X.¬†Minimal residual disease detection by next-generation sequencing of different immunoglobulin gene rearrangements in pediatric B-ALL.¬†Nat Commun. 2023 Nov 17;14(1):7468. doi: 10.1038/s41467-023-43171-9. пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

3гАБMin’er Gu,Yahong Xia, Jingying Zhang, Yongmin Tang, Weiqun Xu, Hua Song ¬†Xiaojun Xu. The effectiveness of blinatumomab in clearing measurable residual disease in pediatric B-cell acute lymphoblastic leukemia patients detected by next-generation sequencing.¬†¬†Cancer Med. 2023 Dec;12(24):21978-21984. doi:10.1002/cam4.6771.¬†

иОЈеЊЧеЫљйЩЕеЄВеЬЇиЃ§еПѓ 2023еєіDelveInsightеЕђеПЄеПСеЄГзЪДMRDеЫљйЩЕеЄВеЬЇз†Фз©ґжК•еСКдЄ≠пЉМиЙЊж≤РиТљ/Seq-MRD¬ЃжШѓдЄ≠еЫљеФѓдЄАдЄАеЃґеЕђеПЄ/дЇІеУБињЫеЕ•еЫљйЩЕи∞Гз†ФеЄВеЬЇжК•еСКгАВDelveInsightжШѓдЄАеЃґйҐЖеЕИзЪДеМїзЦЧдњЭеБ•еЄВеЬЇз†Фз©ґеТМеХЖдЄЪеҮ胥еЕђеПЄпЉМдї•еЕґзО∞жИРзЪДиБФеРИеЄВеЬЇз†Фз©ґжК•еСКдї•еПКдЄЇеМїзЦЧдњЭеБ•и°МдЄЪзЪДеЕђеПЄжПРдЊЫзЪДеЃЪеИґиІ£еЖ≥жЦєж°ИиАМйЧїеРНгАВ

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖжХ∞еНБзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪNature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ
