免疫组学可以在药物临床试验中发挥重要作用,比如通过分析患者的免疫反应和免疫特征,帮助研究人员更好地理解药物的作用机制和潜在的副作用;通过免疫组学研究,可以识别出哪些患者更可能对特定药物产生积极反应,从而实现个性化治疗方案的制定;还可以监测药物治疗过程中患者的免疫状态变化,及时发现潜在的免疫相关不良反应,提高临床试验的安全性和有效性。
今天小编分享一篇高分文章,很好示范了免疫组学在药物临床试验中的应用。该研究证实了个性化DNA疫苗联合抗PD-1疗法治疗晚期肝细胞癌患者的有效性和安全性,并通过免疫组学分析证实了该疗法能够诱导肿瘤抗原特异性T细胞反应。

题目:个性化新抗原疫苗联合帕博利珠单抗治疗晚期干细胞癌:一项1/2期试验
发表期刊:Nature Medicine
影响因子:58.7
发表时间:2024年4月30日
这是一项 36 名患者、单臂、开放、多中心1/2 期研究,研究个性化治疗性癌症疫苗(PTCV)联合帕博利珠单抗(一种PD-1 抑制剂)治疗既往接受过多酪氨酸激酶抑制剂(mTKI)治疗的晚期 HCC 患者。安全性和免疫原性作为主要终点,治疗效果和可行性作为次要终点进行评估。
该研究采用IFNγ 酶联免疫斑点检测评估表位特异性反应;采用bulk TCRβ测序、单细胞RNAseq+TCRseq揭示治疗前后的T细胞免疫变化及发挥主要作用的T细胞亚群;并进行TCR工程T细胞构建,通过体外抗原刺激验证了扩增的T细胞对新抗原具有反应性。
研究结果
01安全性、可行性和临床反应
患者流程图如下,在数据截止日期,25名患者已停止研究治疗,停药的常见原因是疾病进展(n=22)。
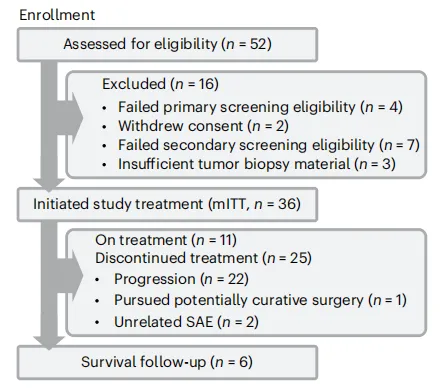
图1
治疗相关不良事件(TRAE):总体而言,该治疗安全且耐受性良好。27例患者(75.0%)观察到低级别TRAEs,无≥3级 TRAEs。3 例患者(8.3%)经历了需要全身性类固醇治疗的免疫相关不良事件(irAE)。
临床反应:36例患者中有3例(8.3%)达到完全缓解(CR),8名(22.2%)达到部分缓解(PR)。疾病控制率为55.6%(36例中的20例)(图2b-d)。图2a为临床试验设计。
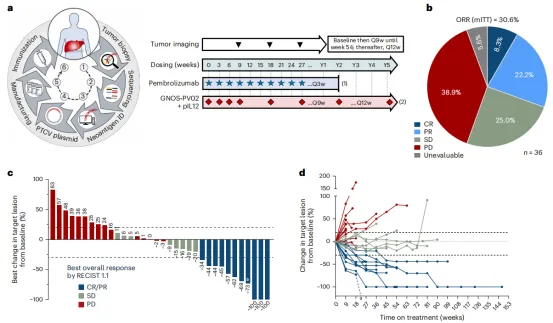
图2
02疫苗接种引发新抗原特异性反应
使用IFNγ酶联免疫吸附点(ELISpot)测定评估22例具有PBMC样本的患者在治疗前后是否存在疫苗诱导的新抗原特异性反应。在几乎所有患者中,治疗都与累积PTCV新抗原特异性 T 细胞反应幅度的增加有关(P < 0.0001)(图3a)。
PTCV治疗还与引发免疫反应的编码新抗原数量的增加有关。在 22 名患者中,有19 名(86.4%)在治疗后具有T细胞反应性的疫苗编码的新抗原数量高于治疗前(图3b)。治疗后PTCV编码的新抗原特异性T细胞应答表位中位数为64.0%,而治疗前应答表位为11.8%。PTCV免疫导致临床反应和无反应患者的阳性表位显著增加(图3c)。
然后通过在体外用患者特异性新表位池刺激的PBMC进行细胞内染色,在4名患者(1例CR,3例PR)的子集中确认了新抗原特异性反应。在新抗原刺激后,CD4+和CD8+群体都表现出增加的激活曲线(图3d)。布尔门控证实活性(CD69+CD107a+)的增加趋势(图3e)和具有溶细胞能力的多功能CD4+和CD8+ T细胞在刺激后增殖(Ki67+)(图3f)。这些数据表明,疫苗接种能够引发具有溶细胞潜力的多功能新抗原特异性CD4+和CD8+反应。

图3
03疫苗接种增加了T细胞克隆的扩增和浸润
对14名患者配对治疗前和治疗后PBMC和肿瘤活检样本进行bulk TCRβ测序。14名患者的外周血和肿瘤组织中均有显著的T细胞克隆扩增(图3g)。与治疗前相比,治疗后肿瘤内扩增的 T 细胞克隆的丰度和数量都有所增加,外周血中也一样(图3h、i)。治疗后肿瘤中TCR克隆性显著增加(图3j),但丰富度没有显著变化(图3k)。这些数据表明,PTCV治疗导致外周T细胞的扩增,T细胞转运到肿瘤。
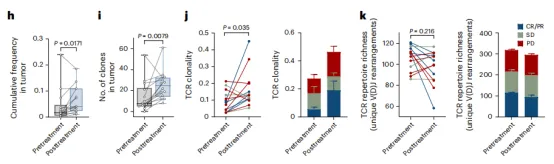
图304扩增的TCR克隆对PTCV编码的抗原具有反应性
作者还对疫苗接种后的外周血样本进行了单细胞RNAseq和TCRseq,以进一步表征疫苗诱导的T细胞反应。发现PTCV扩增的T细胞主要是CD8+TEM簇,其次是CD8+增殖簇,证明了疫苗接种驱动效应T细胞记忆克隆扩增。
然后验证两名代表性患者的肿瘤浸润T细胞的新抗原特异性活性。第一个患者外周血中有42个明显扩增的克隆,其中27个在治疗后的肿瘤样本中存在(图3g和4a)。在接种疫苗后肿瘤新出现的T细胞克隆中,3个最高频的TCR序列(图4b)主要在外周血单细胞测序的CD8+TEM簇中发现(图4c)。将这3条TCR序列克隆到pMXs-IRES(内部核糖体进入位点)-GFP(绿色荧光蛋白)逆转录病毒质粒载体中(图4d)。
用患者的PTCV特异性新抗原池刺激患者来源的PBMCs的TCR工程T细胞,以表征新抗原特异性细胞反应。发现T细胞活化(CD69+)与池1(由新抗原1-20对应的肽组成)相关,其中包括ELISpot检测到的最具反应性的表位;池2(由新抗原21-40对应的肽组成)作为特异性的内部对照,显示出与非特异性表位(CTA1)对照相似的水平(图4e)。
第二个患者中通过TCRseq/RNAseq鉴定出高频TCR,同样进行了工程设计。用包含患者PTCV中所有新抗原的表位池刺激工程TCR。与第一个患者相似,观察到CD4+和CD8+ T细胞对患者特异性新抗原的反应。这些数据验证了疫苗接种后的T细胞浸润和肿瘤中T细胞频率的增加,并对疫苗编码的新抗原具有特异性。
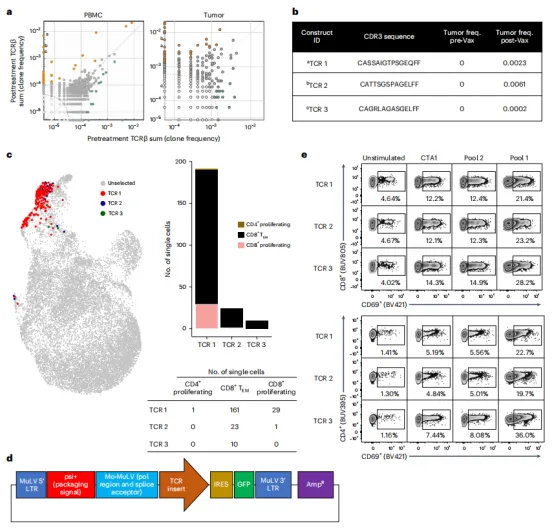
图4
研究结论
该研究表明PTCVs的开发具有可行性,并且可以在晚期HCC中联合抗 PD-1治疗诱导临床反应。并通过免疫组学分析表明PTCV可以通过诱导外周血和肿瘤中的新抗原特异性T细胞来增强对抗PD-1治疗的反应。
该研究将T细胞克隆扩增、转运、新抗原特异性等作为药物临床试验的探索性终点十分具有创新性和前沿性。
参考文献
Yarchoan M, et,al. Personalized neoantigen vaccine and pembrolizumab in advanced hepatocellular carcinoma: a phase 1/2 trial. Nat Med. 2024 Apr;30(4):1044-1053. doi: 10.1038/s41591-024-02894-y. Epub 2024 Apr 7.
艾沐蒽专注于免疫组测序领域多年,开发的ImmuHub®技术平台方法全面,检测物种多样,建库方法具有灵活性,致力于为各大高校、医院、科研机构、企业等提供优良的科研服务。

