
ињСжЬЯеПСи°®дЇОblood advancesпЉИIFпЉЪ7.642пЉЙдЄКзЪДдЄАдЄ™з†Фз©ґйАЪињЗеЕНзЦЂзїДдЇМдї£жµЛеЇПеПСзО∞зЫЄељУдЄАйГ®еИЖзїПеЕЄйЬНе•ЗйЗСжЈЛеЈізШ§пЉИcHLпЉЙе§НеПСжШѓдЄОеИЭиѓКзЪДеОЯеПСиВњзШ§жЧ†еЕ≥зЪДзђђдЇМжђ°еОЯеПСжАІжЈЛеЈізШ§пЉМеєґйАЪињЗеЯЇеЫ†з™БеПШеИЖжЮРиѓБеЃЮдЇЖињЩдЄАеПСзО∞пЉМдЄФеЬ®еѓєйГ®еИЖж†ЈжЬђињЫи°МеЫЮй°ЊжАІеЕЛйЪЖжАІж£АжµЛеТМз™БеПШеИЖжЮРеРОеПСзО∞дЄАдЇЫTзїЖиГЮжЈЛеЈізШ§пЉИTCLпЉЙзЧЕдЊЛ襀胃иѓКжЦ≠дЄЇcHLгАВињЩдЇЫз†Фз©ґеПСзО∞еПѓиГљеѓєдЄіеЇКж≤їзЦЧз≠ЦзХ•еЕЈжЬЙйЗНи¶БжМЗеѓЉжДПдєЙгАВ
дЄЛйЭҐиЃ©жИСдїђжЭ•иѓ¶зїЖдЇЖиІ£дЄАдЄЛеРІпЉБ
иЩљзДґcHLжВ£иАЕж≤їжДИзОЗйЂШпЉМ5еєіжАїзФЯе≠ШзОЗиґЕињЗ90%пЉМдљЖжШѓйЂШиЊЊ25%зЪДcHLжВ£иАЕи°®зО∞дЄЇйЪЊж≤їжАІжИЦе§НеПСзЪДзЦЊзЧЕгАВеЈ≤жЬЙз†Фз©ґиѓБеЃЮеЕНзЦЂзРГиЫЛзЩљпЉИIGпЉЙеЯЇеЫ†йЗНжОТеПѓдљЬдЄЇз°ЃеЃЪеОЯеПСжАІcHLдЄОе§НеПСжАІcHLдєЛйЧіеЕЛйЪЖеЕ≥з≥їзЪДиѓКжЦ≠ж†ЗењЧзЙ©гАВйЩ§дЇЖж£АжµЛIgеЕЛйЪЖжАІе§ЦпЉМеЬ®cHLдЄ≠ињШиІВеѓЯеИ∞еЕЛйЪЖжАІTзїЖиГЮеПЧдљУпЉИTCRпЉЙеЯЇеЫ†йЗНжОТгАВиАМеЬ®TCLдЄ≠TCRйЗНжОТжЫіеЄЄиІБпЉМеЕґйЭЮеЕЄеЮЛBзїЖиГЮз±їдЉЉдЇОcHLпЉМдЇМиАЕеЃєжШУжЈЈжЈЖпЉМйАЪињЗеЯЇеЫ†з™БеПШеИЖжЮРжЬЙеК©дЇОи°•еЕЕдЄіеЇКзЧЕзРЖе≠¶иѓДдЉ∞гАВ
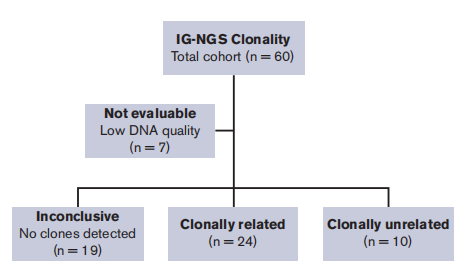
дљЬиАЕеБЗиЃЊдЄАдЇЫжВ£иАЕеЃЮйЩЕдЄКеПѓиГљеЗЇзО∞жЦ∞зЪДдЄОеОЯеІЛиВњзШ§жЧ†еЕ≥зЪДеОЯеПСжАІ cHLпЉМеЫ†иАМиЃЊиЃ°дЇЖиѓ•з†Фз©ґгАВеИЖжЮРдЇЖ 60 еРНcHLжВ£иАЕзЪДйЕНеѓєеИЭиѓКеТМе§НеПСзїДзїЗж†ЈжЬђпЉМйАЪињЗињЫи°МеЯЇдЇОNGSзЪДIgеТМTCRеЕЛйЪЖжАІиѓДдЉ∞еТМйЭґеРСз™БеПШеИЖжЮРжЭ•з°ЃеЃЪcHLеИЭиѓКеТМе§НеПСдєЛйЧізЪДеЕЛйЪЖеЕ≥з≥їгАВ
1гАБж†ЈжЬђйЗЗйЫЖпЉЪйЗЗйЫЖ60дЊЛcHLжВ£иАЕеИЭиѓКеТМе§НеПСжЧґзЪДзїДзїЗж†ЈжЬђпЉМеЕ±130дїљпЉМеМЕжЛђ99дїљFFPEеТМ31дїљжЦ∞й≤ЬеЖЈеЖїзїДзїЗгАВ
2гАБIG/TCR NGSеЕЛйЪЖжАІж£АжµЛпЉЪеПВзЕІEuroClonality-NGSеЈ•дљЬзїДеИґеЃЪзЪДеїЇиЃЃпЉМж£АжµЛIGHгАБIGKжИЦTRBгАБTRGеЯЇеЫ†йЗНжОТгАВ
3гАБеЯЇеЫ†з™БеПШеИЖжЮР
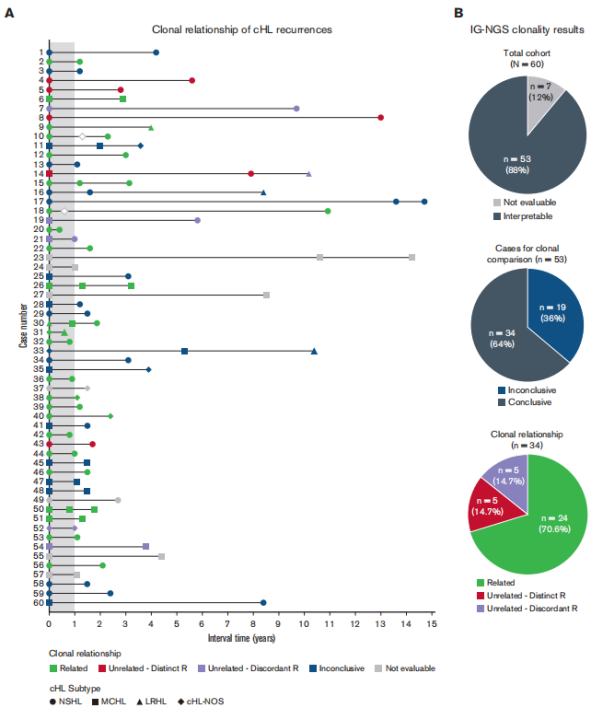
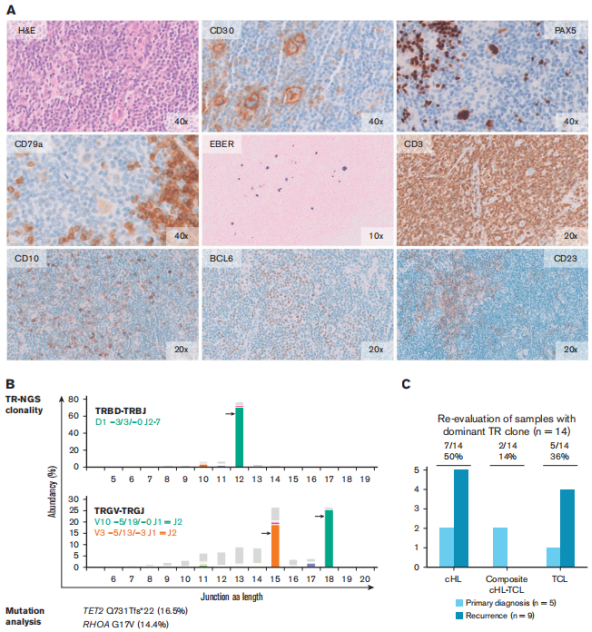
жЬЙ53еРНжВ£иАЕзЪД120дЄ™ж†ЈжЬђзЪДжµЛеЇПзїУжЮЬеПѓзФ®пЉМеЕґдЄ≠69дЄ™ж£АжµЛеИ∞жШЊиСЧжАІеЕЛйЪЖIGеЯЇеЫ†йЗНжОТпЉМиАМ51дЄ™ж†ЈжЬђжШЊз§Їе§ЪеЕЛйЪЖж®°еЉПгАВйЕНеѓєеИЭиѓКеТМе§НеПСж†ЈжЬђзЪДIgеЕЛйЪЖеЮЛжѓФиЊГжШЊз§ЇпЉМеЕ±жЬЙ24дЊЛжВ£иАЕжЬЙзЫЄеРМзЪДжШЊиСЧжАІеЕЛйЪЖеЮЛпЉМиѓБеЃЮжШѓеЕЛйЪЖзЫЄеЕ≥зЪДе§НеПСcHLгАВ
йЩ§24дЊЛеЕЛйЪЖзЫЄеЕ≥зЪДе§НеПСжАІcHLе§ЦпЉМ53дЊЛжВ£иАЕдЄ≠жЬЙ5дЊЛеЬ®йЕНеѓєж†ЈжЬђдЄ≠и°®зО∞еЗЇдЄНеРМзЪДжШЊиСЧжАІеЕЛйЪЖIGеЯЇеЫ†йЗНжОТпЉИзІ∞дЄЇdistinctйЗНжОТпЉЙгАВеЬ®еП¶е§Ц5дЊЛжВ£иАЕдЄ≠пЉМеЬ®еИЭиѓКжИЦе§НеПСж†ЈжЬђдЄ≠ж£АжµЛеИ∞зЪДжШЊиСЧжАІеЕЛйЪЖеЮЛеЬ®йЕНеѓєж†ЈжЬђдЄ≠жЧ†ж≥Хж£АжµЛеИ∞пЉИзІ∞дЄЇdiscordantйЗНжОТпЉЙгАВињЩ10дЄ™зЧЕдЊЛ襀ељТз±їдЄЇеЕЛйЪЖжЧ†еЕ≥зЪДзЧЕдЊЛпЉМи°®жШОе§НеПСжЧґе≠ШеЬ®дЄНеРМзЪДжБґжАІBзїЖиГЮеЕЛйЪЖеТМеЕЛйЪЖдЄНзЫЄеЕ≥зЪДcHLпЉИеЫЊ1пЉЙгАВ
еЬ®жЬђз†Фз©ґйШЯеИЧдЄ≠пЉМйАЪињЗеЯЇдЇОNGSзЪДIGеЯЇеЫ†йЗНжОТж£АжµЛпЉМ53дЊЛжВ£иАЕдЄ≠жЬЙ34дЊЛпЉИ64%пЉЙеПѓдї•еїЇзЂЛеЕЛйЪЖеЕ≥з≥їпЉЫињЩ34дЊЛдЄ≠жЬЙ24дЊЛпЉИ71%пЉЙе§НеПСпЉМжЬЙ10дЊЛпЉИ29%пЉЙи°®зО∞дЄЇеЕЛйЪЖдЄНзЫЄеЕ≥зЪДжЦ∞зФЯcHLгАВеЬ®еЕґдљЩ19дЊЛжВ£иАЕдЄ≠пЉМеЬ®еИЭиѓКеТМ/жИЦе§НеПСзЪДзїДзїЗж†ЗжЬђдЄ≠жЬ™ж£АжµЛеИ∞еЕЛйЪЖжАІIGеЯЇеЫ†йЗНжОТпЉМеѓЉиЗізїУжЮЬдЄНз°ЃеЃЪпЉИеЫЊ2пЉЙгАВ
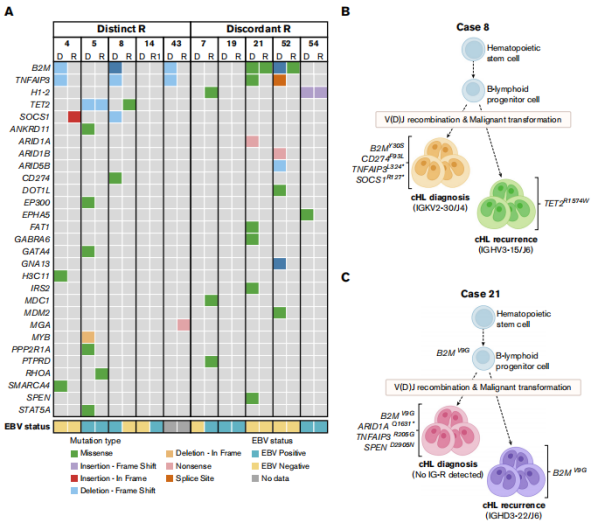
еЫЊ1
еЫЊ2
дЄЇдЇЖиѓБеЃЮдЄКињ∞10дЊЛжВ£иАЕзЦСдЉЉзђђдЇМжђ°еОЯеПСжАІcHLињЩдЄАзїУжЮЬпЉМдљњзФ®TSO500жµЛеЃЪпЉИеє≥еЭЗдЄ≠дљНе§ЦжШЊе≠Ри¶ЖзЫЦзОЗдЄЇ600√ЧпЉЙеѓєйЕНеѓєзЪДеИЭиѓКеТМе§НеПСж†ЈжЬђпЉИn=10пЉЙињЫи°МйЭґеРСз™БеПШеИЖжЮРгАВеЬ®еИЭиѓКеТМе§НеПСжЧґжЬЙжШЊиСЧжАІеЕЛйЪЖйЗНжОТзЪД5дЊЛжВ£иАЕдЄ≠пЉМжЬЙ4дЊЛеЬ®дЄ§дЄ™ж†ЈжЬђдЄ≠йГљеПСзО∞дЇЖзЫЄдЇТжОТжЦ•зЪДеЯЇеЫ†з™БеПШпЉМдљЖжЬЙ1дЊЛжЬЙйЗНеП†зЪДTET2з™БеПШгАВеРМж†ЈпЉМ5дЊЛдЄНдЄАиЗійЗНжОТзЪДжВ£иАЕдЄ≠жЬЙ4дЊЛеЬ®еИЭиѓКеТМе§НеПСжЧґе≠ШеЬ®дЇТжЦ•з™БеПШгАВжАїдєЛпЉМињЩдЇЫйЭґеРСз™БеПШеИЖжЮРиѓБеЃЮдЇЖжЬђз†Фз©ґйШЯеИЧдЄ≠дЄОеЕЛйЪЖжЧ†еЕ≥зЪДcHLзЪДйЙіеЃЪеТМзђђдЇМжђ°еОЯеПСжАІcHLзЪДеПСзФЯпЉИеЫЊ3пЉЙгАВзїУеРИзЧЕдЊЛдЄіеЇКдњ°жБѓпЉМдљЬиАЕиЃ§дЄЇзђђдЇМжђ°жЦ∞еПСжЈЛеЈізШ§зЪДеПСзФЯеПѓиГљдЄОеЕНзր姱и∞ГйЪЬзҐНжИЦжЈЛеЈізШ§жШУжДЯжАІжЬЙеЕ≥гАВ
еЫЊ3
еЬ®43%зЪДcHLж†ЈжЬђдЄ≠пЉМжЬ™ж£АжµЛеИ∞жШЊиСЧеЕЛйЪЖжАІIGеЯЇеЫ†йЗНжОТпЉМињЫиАМеѓє57дЊЛcHLжВ£иАЕзЪДйЕНеѓєеИЭиѓКеТМе§НеПСж†ЈжЬђињЫи°МдЇЖTCR-NGSеЕЛйЪЖжАІиѓДдЉ∞гАВ125дЄ™ж†ЈжЬђдЄ≠жЬЙ14дЄ™пЉИ11%пЉЙжШЊз§ЇеЗЇжШЊиСЧеЕЛйЪЖжАІTRB/TRGеЯЇеЫ†йЗНжОТпЉМиАМеЕґдљЩж†ЈжЬђжШЊз§ЇеЗЇе§ЪеЕЛйЪЖж®°еЉПгАВеЬ®14дЄ™ж†ЈжЬђдЄ≠пЉМжЬЙ5дЄ™ж†ЈжЬђеРМжЧґе≠ШеЬ®еЕЛйЪЖжАІIGеТМTRеЯЇеЫ†йЗНжОТпЉИеЫЊ4пЉЙгАВ
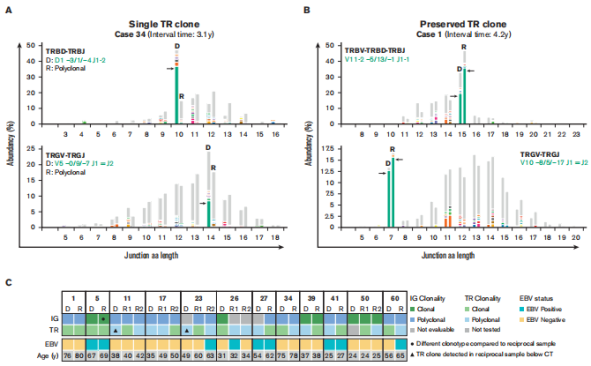
дЄЇдЇЖиѓДдЉ∞TCRеЕЛйЪЖжАІзЪДж£АжµЛжШѓеР¶дЄОcHLе§НеПСзЫЄеЕ≥пЉМжИСдїђеѓєжЬ™е§НеПСзЪДcHLжВ£иАЕзЪДеѓєзЕІйШЯеИЧињЫи°МдЇЖTR-NGSж£АжµЛпЉИn = 48пЉЙгАВеЬ®ињЩйЗМпЉМ48дЄ™ж†ЈжЬђдЄ≠жЬЙ3дЄ™пЉИ6%пЉЙжШЊз§ЇдЇЖеЕЛйЪЖжАІTCRеЯЇеЫ†йЗНжОТпЉМињЩи°®жШОTCRзЪДеЕЛйЪЖжАІжЬђиЇЂеєґдЄНжШѓжЬЙе§НеПСеАЊеРСзЪДcHLжЙАзЛђжЬЙзЪДгАВ
дЄЇдЇЖз°ЃеЃЪеЕЈжЬЙеЕЛйЪЖTCRеЯЇеЫ†йЗНжОТзЪДcHLж†ЈжЬђжШѓеР¶дї£жЫњдЇЖж®°дїњcHLзЪДTCLпЉМжИСдїђеѓєTCLзЫЄеЕ≥еЯЇеЫ†ињЫи°МдЇЖз™БеПШеИЖжЮРпЉМжЭ•иЗ™5дЊЛдїОHLжВ£иАЕзЪД6дЄ™ж†ЈжЬђеЭЗжШЊз§ЇTCLзЫЄеЕ≥еЯЇеЫ†з™БеПШгАВињЩдЇЫеИЖе≠РеПСзО∞и°®жШОTCLж®°дїњcHLгАВйАЪињЗзЧЕзРЖе≠¶еЃ°жЯ•йЗНжЦ∞иѓДдЉ∞еАЩйАЙзїДзїЗж†ЈжЬђпЉМзїУеРИеИЖе≠Ре≠¶еПСзО∞еТМзЧЕзРЖе≠¶еЫЮй°ЊпЉМеПСзО∞ињЩ5дЊЛжВ£иАЕе±ЮдЇОTCLпЉИеЫЊ5пЉЙгАВ
TCLиґКжЭ•иґК襀聧䪯жШѓcHLиГМжЩѓдЄЛзЪДиѓКжЦ≠йЩЈйШ±гАВеЫ†ж≠§пЉМдљЬиАЕиЃ§дЄЇеЬ®еЄЄиІДиѓКжЦ≠дЄ≠еЇФиАГиЩСињЫи°МTCRеЕЛйЪЖжАІиѓДдЉ∞еТМпЉИжИЦпЉЙйЭґеРСTCLзЫЄеЕ≥еЯЇеЫ†з™БеПШеИЖжЮРпЉМдї•йБњеЕНеܮ嚥жАБе≠¶жИЦдЄіеЇКжААзЦСдї•еПКзЦЊзЧЕе§НеПСзЪДжГЕеЖµдЄЛиѓѓиѓКгАВ
еЫЊ4
еЫЊ5
з†Фз©ґиѓБжШОзЫЄељУдЄАйГ®еИЖе§НеПСзЪДcHLеЕґеЃЮжШѓеОЯеПСиВњзШ§жЧ†еЕ≥зЪДжЦ∞еПСжЈЛеЈізШ§пЉМйАЪињЗеЕЛйЪЖжАІиѓДдЉ∞еТМз™БеПШеИЖжЮРжЬЙеК©дЇОйБњеЕНTCL襀胃иѓКдЄЇcHLгАВињЩдЇЫеПСзО∞еЕЈжЬЙйЗНи¶БзЪДдЄіеЇКжДПдєЙпЉМеЫ†дЄЇињЩдЇЫжВ£иАЕеЇФиѓ•жО•еПЧдЄНеРМзЪДж≤їзЦЧз≠ЦзХ•гАВеѓєдЇО2еєіеРОе§НеПСзЪДcHLжВ£иАЕпЉМеЄЄиІДиѓКжЦ≠еЇФиАГиЩСеЯЇдЇОNGSзЪДеЕЛйЪЖжАІиѓДдЉ∞зїУеРИйЭґеРСз™БеПШеИЖжЮРгАВ
еПВиАГжЦЗзМЃ
van Bladel DAG, Stevens WBC, Kroeze LI, et al. A significant proportion of classic Hodgkin lymphoma recurrences represents clonally unrelated second primary lymphoma. Blood Adv. 2023 Oct 10;7(19):5911-5924.
жКАжЬѓеОЯзРЖ
жѓПзІНB/TжЈЛеЈізїЖиГЮи°®йЭҐеЭЗе≠ШеЬ®дЄАзІНзЙєеЉВжАІBзїЖиГЮеПЧдљУпЉИB cell receptor,BCR/Ig)/TзїЖиГЮеПЧдљУ (T cell receptor,TCR)пЉМзФ±дЇОBCR/TCRеЫ†дЄ≠VгАБDгАБJеЯЇеЫ†зЙЗжЃµйЗНзїДдЄО祱еЯЇзЪДйЪПжЬЇжПТеЕ•гАБеИ†еЗПпЉМеѓЉиЗіBCR/TCRеЕЈжЬЙйЂШеЇ¶е§Ъж†ЈжАІзЪДзЙєзВєпЉМдїОиАМBCR/TCRеПѓдљЬдЄЇжѓПдЄ™B/TжЈЛеЈізїЖиГЮеФѓдЄАзЪДеИЖе≠Рж†Зз≠ЊгАВ
жЈЛз≥їи°Ажґ≤зЩМзЧЗжВ£иАЕеЫ†B/TжЈЛеЈізїЖиГЮеПСзФЯзЩМеПШпЉМзЩМзїЖиГЮзїІиАМиЗ™жИСе§Неȴ嚥жИРеЕЛйЪЖжАІеҐЮжЃЦпЉМеЫ†ж≠§пЉМйАЪињЗж£АжµЛB/TжЈЛеЈізїЖиГЮи°®йЭҐеПЧдљУBCR/TCRеПѓдї•йЙіеЃЪзЩМзїЖиГЮеєґињљиЄ™ж£АжµЛзЩМзїЖиГЮзЪДеК®жАБеПШеМЦгАВ
ж£АжµЛз±їеЮЛ
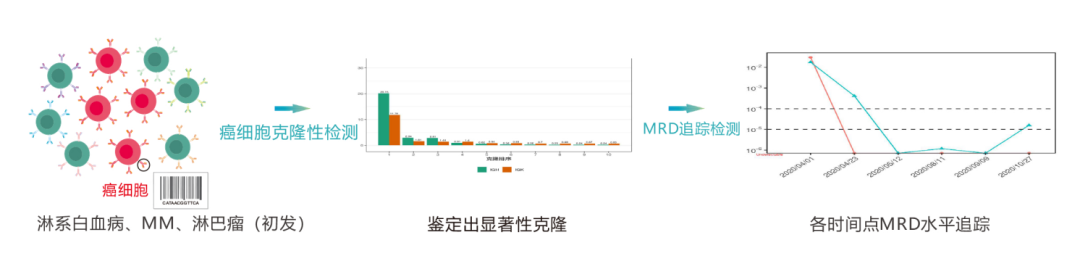
1.зЩМзїЖиГЮеЕЛйЪЖжАІж£АжµЛ
йАЪињЗжВ£иАЕеИЭиѓКжИЦзЩМзїЖиГЮйЂШиіЯиНЈжЧґзЪДй™®йЂУж†ЈжЬђпЉМжЙЊеИ∞зЩМзїЖиГЮзЙєжЬЙзЪДDNAвАЬж†Зз≠ЊвАЭеЇПеИЧгАВ
2.MRDињљиЄ™ж£АжµЛ
еИ©зФ®з≠ЫжЯ•еЗЇзЪДDNAвАЬж†Зз≠ЊвАЭеЇПеИЧпЉМеЬ®ж≤їзЦЧжЬЯйЧіжИЦж≤їзЦЧеРОиѓДдЉ∞MRDж∞іеє≥пЉМзЫСжµЛзЩМзїЖиГЮеРЂйЗПпЉМеРМжЧґж£АжµЛиѓЖеИЂжЦ∞еЗЇзО∞зЪДзЩМзїЖиГЮеЇПеИЧгАВ
йАВзФ®дЇЇзЊ§
1. Bз≥їи°Ажґ≤з≥їзїЯзЩМзЧЗ
жА•жАІ/жЕҐжАІBжЈЛеЈізїЖиГЮзЩљи°АзЧЕгАБе§ЪеПСжАІй™®йЂУзШ§гАБBеЮЛжЈЛеЈізШ§гАВ
2. Tз≥їи°Ажґ≤з≥їзїЯзЩМзЧЗ
жА•жАІ/жЕҐжАІTжЈЛеЈізїЖиГЮзЩљи°АзЧЕгАБTеЮЛжЈЛеЈізШ§гАВ
жДПдєЙ
Seq-MRD¬ЃиГљжПРдЊЫйЂШз≤ЊеЇ¶гАБйЂШзБµжХПеЇ¶зЪДMRDж£АжµЛиІ£еЖ≥жЦєж°ИпЉМеПѓеЄЃеК©еМїзФЯжЫіеЗЖз°ЃеЬ∞иѓДдЉ∞зЩМзЧЗжВ£иАЕзЪДж≤їзЦЧеПНеЇФеТМйҐДеРОгАВињЩдЇЫжКАжЬѓеЬ®зО∞дї£иВњзШ§ж≤їзЦЧдЄ≠жЙЃжЉФзЭАиґКжЭ•иґКйЗНи¶БзЪДиІТиЙ≤пЉМеЫ†дЄЇеЃГдїђиГље§ЯеЄЃеК©еМїзФЯиѓЖеИЂйВ£дЇЫжВ£зЧЕе§НеПСй£ОйЩ©йЂШзЪДжВ£иАЕпЉМеєґдЄЇдїЦдїђжПРдЊЫжЫідЄ™жАІеМЦгАБжЫіжЬЙйТИеѓєжАІзЪДж≤їзЦЧжЦєж°ИгАВ
иОЈеЊЧжђІзЫЯCEиµДиі®иЃ§иѓБ
Seq-MRD¬ЃиОЈеЊЧжђІзЫЯCEиµДиі®пЉИж≥®еЖМеПЈпЉЪDE/CA20/01-IVD-Luxuslebenswelt-190/22пЉЙпЉМиОЈжЙєзЪДжШѓдЇЇжЈЛеЈіBзїЖиГЮеЊЃе∞ПжЃЛзХЩзЧЕеЯЇеЫ†ж£АжµЛиѓХеЙВзЫТпЉИеПѓйАЖжЬЂзЂѓзїИж≠ҐжµЛеЇПж≥ХпЉЙгАВ

иОЈеЊЧдЄЙй°єеПСжШОдЄУеИ©
иЙЊж≤РиТљжО®еЗЇзЪДSeq-MRD¬Ѓи°Ажґ≤зЩМзЧЗMRDж£АжµЛжШѓжЬАжЧ©жЙєеЃЮзО∞еХЖдЄЪеМЦзЪДдЇІеУБпЉМиЗ™2016еєіз†ФеПСдЄУеИ©жКАжЬѓиЗ≥дїКпЉМиЙЊж≤РиТљSeq-MRD¬ЃеЈ≤зїПиОЈеЊЧ3й°єеЫљеЃґеПСжШОдЄУеИ©пЉЪ
[1]вАЬдЄАзІНеЇФзФ®дЇОйЂШйАЪйЗПжµЛеЇПж£АжµЛTзїЖиГЮзЩљи°АзЧЕеЊЃе∞ПжЃЛзХЩзЧЕзЪДеЉХзЙ©зїДеРИеПКиѓХеЙВзЫТвАЭпЉИдЄУ еИ© еПЈ: 2016 11204857.0пЉМжОИжЭГеЕђеСКеПЈ:CN 106957906 BпЉЙ
[2]вАЬдЄАзІНж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕMRDзЪДиѓХеЙВзЫТвАЭпЉИдЄУ еИ© еПЈ: 2018 1 1550133.0пЉМжОИжЭГеЕђеСКеПЈ: CN 109652518 BпЉЙ
[3]вАЬдЄАзІНж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕMRDзЪДжЦєж≥ХвАЭпЉИдЄУ еИ© еПЈ: 2018 1 1549203.0пЉМжОИжЭГеЕђеСКеПЈ: CN 109680062 BпЉЙ

еПСи°®зЫЄеЕ≥жЦЗзМЃ
Seq-MRD¬ЃеПСи°®зЫЄеЕ≥жЦЗзМЃ
Huang Y, Zhao H, Shao M, Zhou L, Li X, Wei G, Wu W, Cui J, Chang AH, Sun T, Hu Y, Huang H. Predictive value of next-generation sequencing-based minimal residual disease after CAR-T cell therapy. Bone Marrow Transplant. 2022 Jun 1. doi: 10.1038/s41409-022-01699-2. Epub ahead of print. PMID: 35650329.пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

иОЈеЊЧеЫљйЩЕеЄВеЬЇиЃ§еПѓ
2023еєіDelveInsightеЕђеПЄеПСеЄГзЪДMRDеЫљйЩЕеЄВеЬЇз†Фз©ґжК•еСКдЄ≠пЉМиЙЊж≤РиТљ/Seq-MRD¬ЃжШѓдЄ≠еЫљеФѓдЄАдЄАеЃґеЕђеПЄ/дЇІеУБињЫеЕ•еЫљйЩЕи∞Гз†ФеЄВеЬЇжК•еСКгАВDelveInsightжШѓдЄАеЃґйҐЖеЕИзЪДеМїзЦЧдњЭеБ•еЄВеЬЇз†Фз©ґеТМеХЖдЄЪеҮ胥еЕђеПЄпЉМдї•еЕґзО∞жИРзЪДиБФеРИеЄВеЬЇз†Фз©ґжК•еСКдї•еПКдЄЇеМїзЦЧдњЭеБ•и°МдЄЪзЪДеЕђеПЄжПРдЊЫзЪДеЃЪеИґиІ£еЖ≥жЦєж°ИиАМйЧїеРНгАВ


жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ |TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


