2023еєі8жЬИ30жЧ•пЉМиЙЊж≤РиТљеК©еКЫйЩЖеЖЫеЖЫеМїе§Іе≠¶еЬ®гАКзїЖиГЮдЄОеИЖе≠РеЕНзЦЂе≠¶гАЛпЉИCellular & Molecular ImmunologyпЉЙпЉИIF=24пЉЙдЄКеПСи°®йҐШдЄЇвАЬи°∞иАБй™®йЂУйА†и°Аеє≤зїЖиГЮеКЂжМБи∞ГиКВжАІTзїЖиГЮиР•йА†дњГеЕґе≠ШжіїзЪДеЊЃзОѓеҐГпЉИAged hematopoietic stem cells entrap regulatory T cells to create a prosurvival microenvironmentпЉЙвАЭзЪДз†Фз©ґиЃЇжЦЗгАВз†Фз©ґдљњзФ®иЙЊж≤РиТљзФЯзЙ©ImmuHub¬Ѓ¬†TCRеИЖжЮРз≥їзїЯпЉМз†Фз©ґиІ£жЮРдЇЖзФµз¶їиЊРе∞ДиЗій™®йЂУйА†и°АињЬжЬЯжНЯеЃ≥зЪДжХИеЇФдЄОжЬЇеИґпЉМжЛУе±ХдЇЖи°∞иАБйА†и°Аеє≤зїЖиГЮ(HSCs)е≠ШжіїеПКдЉШеКњжЙ©еҐЮеПСзФЯжЬЇеИґзЪДиЃ§иѓЖпЉМдЄЇзФµз¶їиЊРе∞ДиЗій™®йЂУйА†и°АињЬжЬЯжНЯеЃ≥зЪДйШ≤ж≤їжПРдЊЫдЇЖжЦ∞жАЭиЈѓгАВ
дЄЛйЭҐе∞±иЃ©жИСдїђдЄАиµЈдЇЖиІ£дЄАдЄЛпЉБ

з†Фз©ґиГМжЩѓ
¬†¬†¬†¬†¬†¬†¬†зїДзїЗй©їзХЩдљУзїЖиГЮз®≥жАБзЪДиІ£й٧襀聧䪯жШѓи°∞иАБињЗз®ЛзЪДеЕ≥йФЃеЫ†зі†пЉМйА†и°Аеє≤зїЖиГЮ(HSCs)зЪДи°∞иАБжФѓжТСзЭАз≥їзїЯеЩ®еЃШжЬЙйЩРзЪДеБ•еЇЈиЈ®еЇ¶пЉМйА†и°Аеє≤зїЖиГЮжШѓз†Фз©ґеє≤зїЖиГЮи°∞иАБзЪДдЄАдЄ™еЊИе•љзЪДиМГдЊЛгАВHSCиАБеМЦзЪДзЙєеЊБжШѓйЗНжЮДиГљеКЫйЩНдљОгАБй™®йЂУеБПеРСжАІHSCsжЙ©е§ІгАБе§НеИґеЇФжњАеҐЮеК†гАБDNAз™БеПШзІѓзіѓгАБзїЖиГЮеЗЛдЇ°жКµжКЧиГљеКЫеҐЮеЉЇгАБиЗ™еЩђиГљеКЫ䪲姱俕еПКи°®иІВйБЧдЉ†гАБиљђељХеТМзњїиѓСжФєеПШгАВзДґиАМпЉМHSCиАБеМЦињЩдЇЫзЙєеЊБзЪДжЬЇеИґзЫЄдЇТеЕ≥з≥їеТМз≠ЙзЇІй°ЇеЇПе∞ЪжЬ™жШОз°ЃгАВзЙєеИЂжШѓпЉМеЉХиµЈHSCи°∞иАБзЪДиµЈеІЛдЇЛдїґзЪДжАІиі®еТМжЧґйЧіеЬ®еЊИе§Із®ЛеЇ¶дЄКдїНзДґжЬ™зЯ•пЉМеЫ†ж≠§жЧ†ж≥ХдїОжЧ©жЬЯйҐДйШ≤HSCи°∞иАБгАВ
¬†¬†¬†¬†¬†¬†¬†иѓ•з†Фз©ґдљњзФ®жЧ©и°∞еТМдЄ≠еєіе∞ПйЉ†ж®°еЮЛпЉМеПСзО∞еєґи°®еЊБдЇЖBM TregsеЬ®HSCи°∞иАБдЄ≠зЪДзЛђзЙєеКЯиГљгАВз†Фз©ґеПСзО∞пЉМи°∞иАБHSCsдЄ≠зЪДDNAз™БеПШзІѓзіѓеПѓиѓ±еѓЉдЄїи¶БзїДзїЗзЫЄеЃєжАІе§НеРИдљУIIз±ї(MHCII)дЄКи∞ГеТМBM TregеЕЛйЪЖжЙ©еҐЮгАВж≠§е§ЦпЉМйАЪињЗMHCII -TзїЖиГЮеПЧдљУ(TCR)зЪДеПВдЄОпЉМи°∞иАБHSCsдЄОBM TregsдєЛйЧіеїЇзЂЛдЇЖеПМеРСзЫЄдЇТдљЬзФ®пЉМйАЪињЗTCRиѓЖеИЂи°∞иАБHSCsдЄКзЪДMHCIIпЉМBM TregsеЊЧдї•жЙ©е±ХпЉМиАМйАЪињЗйЧійЪЩињЮжО•(GJ)дїЛеѓЉзЪДBM TregsдЄ≠зОѓз£ЈйЕЄиЕЇиЛЈ(cAMP)зЪДиљђзІїпЉМи°∞иАБHSCsзЪДеЗЛдЇ°еРѓеК®еЊЧдї•еЗПеЉ±гАВйЗНи¶БзЪДжШѓпЉМйЭґеРСHSC-TregsзЫЄдЇТдљЬзФ®еПѓдї•йШ≤ж≠ҐHSCеЬ®жЧ©жЬЯи°∞иАБгАВ
жЦєж≥Хе≠¶
-
RNA-seqпЉЪеЬ®ињЩй°єз†Фз©ґдЄ≠пЉМдљњзФ®жµБеЉПзїЖиГЮжЬѓеѓєдЇОHSCеТМBMзїЖиГЮињЫи°МзїЖиГЮеИЖйАЙпЉМдїОе∞ПйЉ†й™®йЂУдЄ≠еИЖйАЙйА†и°Аеє≤зїЖиГЮеТМtregпЉМжПРеПЦRNAпЉМињЫи°МRNA-seqгАВ
-
TCRќ≤жЙ©еҐЮеТМжµЛеЇПпЉЪTCRќ≤жµЛеЇПжЧґпЉМеѓєBM TregsињЫи°МеИЖз±їпЉМеєґжПРеПЦRNAгАВйЪПеРОпЉМйАЪињЗиЙЊж≤РиТљзФЯзЙ© ImmuHub¬ЃжКАжЬѓеѓєBM Tregs¬†TCRќ≤йУЊйЗЗзФ®5 ‘ RACEж≥ХињЫи°МжЦЗеЇУжЮДеїЇеТМйЂШйАЪйЗПжµЛеЇПгАВ
-
еЕ®е§ЦжШЊе≠РзїДж£АжµЛпЉЪе∞Ж5еП™е∞ПйЉ†зЪДй™®йЂУйА†и°Аеє≤зїЖиГЮињЫи°МеИЖз±їж±ЗжАїпЉМжПРеПЦеЯЇеЫ†зїДDNAињЫи°МжЈ±еЇ¶WESж£АжµЛгАВ
з†Фз©ґзїУжЮЬ
01 HSCжЧ©жЬЯи°∞иАБдЉійЪПBM TregеЕЛйЪЖжАІжЙ©еҐЮ
¬†¬†¬†¬†¬†¬†¬†жЬАеИЭпЉМдљЬиАЕйЗЗзФ®дЇЖдЄАзІНеЕђиЃ§зЪДе∞ПйЉ†жЧ©и°∞ж®°еЮЛпЉМе∞Же∞ПйЉ†жЪійЬ≤дЇОзФµз¶їиЊРе∞Д(IR)дЄ≠пЉМињЩжШѓдЄАзІНдЉЧжЙАеС®зЯ•зЪДиѓ±еПШеЙВгАВињЩдЄОзФЯзРЖжАІйА†и°АиАБеМЦз±їдЉЉпЉМHSCиАБеМЦзЪДзЙєеЊБпЉМеМЕжЛђжЙ©еЉ†(еЫЊ1AпЉЙпЉМйЗНжЮДиГљеКЫеПЧжНЯ(еЫЊ1B)еТМй™®йЂУеБПеРСеИЖеМЦ(еЫЊ1C)жШѓжШОжШЊзЪДпЉМеЬ®IR (mpi)еРО3дЄ™жЬИе∞ПйЉ†дЄ≠жШОжШЊеПѓиІБпЉМеРМжЧґBMзїЖиГЮжХ∞йЗПйАВеЇ¶еҐЮеК†(и°•еЕЕеЫЊ1b)гАВеЬ®иљђељХзїДж∞іеє≥дЄКпЉМдЄОиАБеєіе∞ПйЉ†(18-24дЄ™жЬИе§І)з±їдЉЉпЉМIRе∞ПйЉ†зЪДBM HSCи°®зО∞еЗЇйЂУз≥їеБПеАЪ(еЫЊ1D)пЉМеєґдЄФдљњзФ®aging signature(еЫЊ1E)дЇ§еПЙй™МиѓБдЇЖи°∞иАБзЙєеЊБпЉМиѓ•зЙєеЊБжПРдЊЫдЇЖе∞ПйЉ†HSCи°∞иАБзЪДеЕ®йЭҐиљђељХзїДзЙєеЊБгАВдї§дЇЇжГКиЃґзЪДжШѓпЉМеѓєдЇОBM TзїЖиГЮпЉМдљЬиАЕиІВеѓЯеИ∞CD4+ TзїЖиГЮеЬ®IRе∞ПйЉ†дЄ≠жЙ©еҐЮ(еЫЊ1F,G)гАВеЬ®CD4+TзїЖиГЮдЄ≠пЉМйЩ§еЄЄиІДCD4+TзїЖиГЮ(Tconv)е§ЦпЉМFoxp3+¬†TregsзЪДжѓФдЊЛеТМжХ∞йЗПеЬ®IRе∞ПйЉ†дЄ≠жШЊиСЧеҐЮеК†(еЫЊF,G)гАВе§Іе§ЪжХ∞дљНдЇОе§ЦеС®зїДзїЗзЪДи∞ГиКВжАІTзїЖиГЮжШѓдїОиГЄиЕЇиЊУеЗЇзЪД(зІ∞дЄЇtTreg)гАВињЩдЄОзФЯзРЖжАІи°∞иАБз±їдЉЉпЉМIRе∞ПйЉ†иГЄиЕЇзїЖиГЮпЉМеМЕжЛђTregжХ∞йЗПпЉМзФ±дЇОIRиѓ±еѓЉзЪДиГЄиЕЇиРОзЉ©жШЊиСЧдЄЛйЩН(еЫЊ1H)гАВTregзЪДзІѓзіѓдєЯеПѓиГљжЇРдЇОTconvзЪДTregи°®еЮЛиљђеМЦ(зІ∞дЄЇpTreg)жИЦзїДзїЗеЖЕTregзЪДе±АйГ®жЙ©еҐЮгАВж†єжНЃдљњзФ®ињЩдЇЫpTregзФЯжИРзЪДиљђељХзїДжХ∞жНЃпЉМдљЬиАЕе∞ЖpTregзЙєеЊБеП†еК†еИ∞зБЂе±±еЫЊдЄКпЉМеєґе∞ЖIRе∞ПйЉ†зЪДBM TregиљђељХзїДдЄОеѓєзЕІ(Ctrl)е∞ПйЉ†зЪДиљђељХзїДињЫи°МжѓФиЊГпЉМеПСзО∞ж≤°жЬЙжШОжШЊзЪДTconv-Tregи°®еЮЛиљђжНҐињєи±°(еЫЊ1I)гАВдЄОиДЊTregs (SP)еТМжЈЛеЈізїУTregs (LN)зЫЄдЉЉпЉМBM TregsеЕЈжЬЙHelioshiNrp-1hiи°®еЮЛ(еЫЊ1J)пЉМињЩ襀聧䪯жШѓеМЇеИЖtTregsеТМpTregsзЪДдЄАзІНи°®еЮЛгАВињЩдЇЫжХ∞жНЃи°®жШОpTregsеѓєIRеРОBM TregжЙ©еЉ†зЪДиі°зМЃеЊИе∞ПгАВTCRеЇУжШЊз§ЇIRе∞ПйЉ†дЄ≠BM TregsзЪДеЕЛйЪЖжЙ©еҐЮ(еЫЊ1K, L)гАВж≠§е§ЦпЉМдљЬиАЕињШеПСзО∞IRе∞ПйЉ†зЪДBMдЄ≠Ki67+ TregsзЪДжѓФдЊЛжШЊиСЧеҐЮеК†пЉМиАМдЄНжШѓSPжИЦLN(еЫЊ1M)пЉМеПНжШ†дЇЖBM TregsзЪДзЙєеЉВжАІеЕЛйЪЖеҐЮжЃЦгАВ
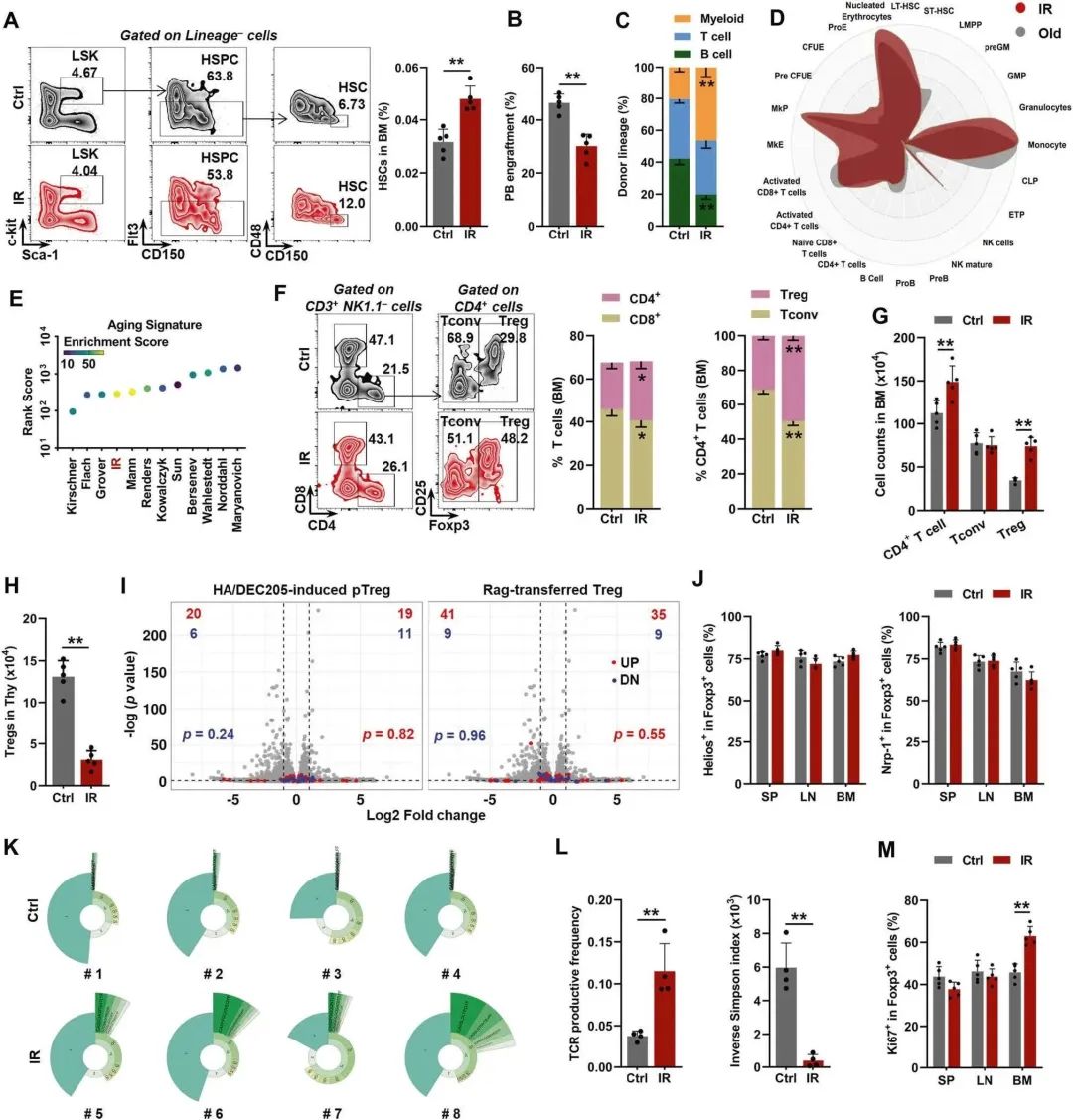
еЫЊ1
02¬†MHCII-TCRеПВдЄОиІ¶еПСиАБеєіHSCеТМBM tregдєЛйЧізЪДеПМеРСзЫЄдЇТдљЬзФ®
       
¬†¬†¬†¬†¬†¬†¬†BM TregsзЪДеЕЛйЪЖжЙ©еҐЮи°®жШОпЉМBM TregsеПѓиГљйАЪињЗTCRиѓЖеИЂBMй©їзХЩжКЧеОЯеСИйАТзїЖиГЮ(APCs)и°®йЭҐзЪДMHCIIеСИйАТзЪДеРМжЇРжКЧеОЯиАМ襀жњАжіїгАВеЃЮйЩЕдЄКпЉМйАЪињЗRNA-seqиІВеѓЯеИ∞IRе∞ПйЉ†BM TregsдЄ≠TCRдњ°еПЈзЪДжШЊиСЧжњАжії(еЫЊ2A)гАВйАЪињЗеИЖжЮРдЇЖMHCIIеЬ®й™®йЂУдЄ≠зЪДдЄУдЄЪAPCs(еМЕжЛђDcзїЖиГЮгАБBзїЖиГЮеТМеЈ®еЩђзїЖиГЮ(MACs))дї•еПКжЬАињС襀йЙіеЃЪдЄЇзЖЯзїГAPCsзЪДHSCдЄКзЪДи°®иЊЊгАВеЬ®IRе∞ПйЉ†зЪДHSCдЄ≠ж£АжµЛеИ∞MHCIIиАМйЭЮMHCIзЪДжШЊиСЧдЄКи∞Ги°®иЊЊ(еЫЊ2B)гАВзЫЄеЇФеЬ∞пЉМRNA-seqдєЯжП≠з§ЇIRе∞ПйЉ†йА†и°Аеє≤зїЖиГЮдЄ≠MHCIIдїЛеѓЉзЪДжКЧеОЯеСИйАТйАФеЊДжШОжШЊжњАжії(еЫЊ2A)гАВйЙідЇОBM TregsеЬ®дЇЇдљУеТМе∞ПйЉ†дљУеЖЕз®≥жАБжЧґйГљеЃЪдљНдЇОHSCйЩДињСпЉМMHCIIеЬ®IRе∞ПйЉ†зЪДHSCдЄКеСИзМЃеРМжЇРжКЧеОЯеПѓиГљжШѓBM TregsеЕЛйЪЖжЙ©еҐЮзЪДеОЯеЫ†гАВдЄЇдЇЖжФѓжМБињЩдЄАеПСзО∞пЉМзїДзїЗе≠¶еИЖжЮРжШЊз§ЇпЉМдЄОеѓєзЕІзїДзЫЄжѓФIRе∞ПйЉ†зЪДйА†и°Аеє≤зїЖиГЮпЉМзЙєеИЂжШѓMHCII+йА†и°Аеє≤зїЖиГЮпЉМжѓФй™®йЂУдЄ≠зЪДTconvжИЦCD8+TзїЖиГЮжЫіжО•ињСTregпЉИеЫЊ2C-EпЉЙпЉМ47.2%зЪДйА†и°Аеє≤зїЖиГЮдЄОзЫіжО•зЪДTregжО•иІ¶пЉИеЬ®Treg10ќЉmеЖЕпЉЙгАВж†єжНЃMHCIIзЪДи°®иЊЊпЉМдљЬиАЕе∞ЖйА†и°Аеє≤зїЖиГЮеИТеИЖдЄЇMHCIIhiеТМMHCIIloдЇЪзЊ§пЉИеЫЊ2FпЉЙгАВдљЬиАЕеПСзО∞пЉМдїО1 mpiеЉАеІЛпЉМMHCIIhi HSCзЪДжѓФдЊЛеТМжХ∞йЗПйАРжЄРжА•еЙІеҐЮеК†пЉМиАМMHCIIlo HSCзЪДжѓФдЊЛжА•еЙІеЗПе∞СпЉМе∞љзЃ°еЃГдїђзЪДжХ∞йЗПеП™жШѓиљїеЊЃдЄЛйЩН(еЫЊ2G)гАВеЬ®дЄОOTII na√ѓve CD4+ TзїЖиГЮеЕ±еЯєеЕїдЄ≠пЉМиѓБеЃЮжЭ•иЗ™IRе∞ПйЉ†зЪДMHCIIhi¬†HSCжѓФеЃГдїђзЪДMHCIIloеРМз±їеЕЈжЬЙжЫіеЉЇзЪДжКЧеОЯеСИйАТиГљеКЫгАВеЬ®дљУе§ЦпЉМеЬ®MHCIIhi HSCдЄОIRе∞ПйЉ†иЗ™дљУзЪДBM TregеЕ±еЯєеЕїз≥їзїЯдЄ≠пЉМиІВеѓЯеИ∞жШЊиСЧзЪДTregеҐЮжЃЦпЉМиАМйАЪињЗTranswellеЃ§еИЖз¶їжИЦзФ®еНХеЕЛйЪЖжКЧдљУ(ќ±MHCII)йШїжЦ≠MHCIIжШЊиСЧеЬ∞жґИйЩ§дЇЖеҐЮжЃЦдљЬзФ®(еЫЊ2H)гАВињЩдЇЫжХ∞жНЃи°®жШОпЉМTCRеѓєIRе∞ПйЉ†йА†и°Аеє≤зїЖиГЮдЄКMHCIIзЪДиѓЖеИЂеИЇжњАдЇЖBM TregsзЪДеЕЛйЪЖжЙ©еҐЮгАВ
¬†¬†¬†¬†¬†¬†¬†дЄїжИРеИЖеИЖжЮР(PCA)жШЊз§ЇпЉМIRе∞ПйЉ†зЪДMHCIIhi¬†HSCдЄОеѓєзЕІе∞ПйЉ†зЪДMHCIIhiеТМMHCIIlo HSCе≠ШеЬ®еЊИе§ІеЈЃеЉВпЉМиАМIRе∞ПйЉ†зЪДMHCIIlo HSCдЄОеѓєзЕІе∞ПйЉ†зЪДMHCIIhiеТМMHCIIlo HSCдїЕе≠ШеЬ®дЄ≠еЇ¶еЈЃеЉВ(еЫЊ2I)гАВеРМжЧґпЉМIRе∞ПйЉ†зЪДMHCIIhi HSCи°®зО∞еЗЇжЫійЂШзЪДи°∞иАБзЙєеЊБз≠ЙзЇІиѓДеИЖ(еЫЊ2J)гАВињЩжДПеС≥зЭАMHCIIдЄКи∞ГеПѓиГљж†ЗењЧзЭАHSCињЗжЧ©и°∞иАБгАВдЄЇдЇЖжФѓжМБињЩдЄАеПСзО∞пЉМйАЪињЗжЭ•иЗ™IRе∞ПйЉ†зЪДMHCIIlo HSCзЫЄжѓФпЉМеЃГдїђзЪДMHCIIhiеѓєеЇФзЙ©еЬ®е§ЦеС®и°А(PB)еТМBMдЄ≠йГљжШЊз§ЇеЗЇжШОжШЊиЊГдљОзЪДйЗНеїЇиГљеКЫпЉМеєґдЉіжЬЙжЫіжШОжШЊзЪДй™®йЂУеБПеАЪ(еЫЊ2K)гАВзДґиАМпЉМйШїжЦ≠MHCIIжИЦTranswellеЯєеЕїеЗ†дєОеПѓдї•жґИйЩ§ињЩдЇЫељ±еУН(еЫЊ2L)гАВеЬ®дљУеЖЕпЉМFoxp3GFP-DTRе∞ПйЉ†зЪДTregжґИиАЧдєЯжШЊиСЧжМљжХСдЇЖMHCIIhi HSCзЪДињЗеЇ¶и°®иЊЊеТМHSCзЪДиАБеМЦи°®еЮЛ(еЫЊ2M, NпЉЙпЉМиАМдЄНиѓ±еѓЉTconvеТМCD8+ TзїЖиГЮзЪДжШЊиСЧжњАжіїгАВињЗDTзЯ≠жЬЯжґИиАЧTregеРОTregжХ∞йЗПеПНеЉєеЬ®IRе∞ПйЉ†дЄ≠дїЕйГ®еИЖеПСзФЯпЉМињЩеПѓиГљжШѓзФ±дЇОиГЄиЕЇиРОзЉ©еТМжњАжіїзЪДTconvsзЉЇдєПTregиљђеМЦгАВзЙєеИЂжШѓпЉМзЫЄељУжѓФдЊЛзЪДBM TregsеЬ®з®≥жАБињЗз®ЛдЄ≠еЃЪдљНдЇОйА†и°Аеє≤зїЖиГЮеТМCD8+ TзїЖиГЮйЩДињСпЉМCD8+ TзїЖиГЮзЫіжО•еТМ/жИЦйЧіжО•и∞ГиКВж≠£еЄЄеТМеЉВеЄЄйА†и°Аеє≤зїЖиГЮзЪДзїіжМБгАВзДґиАМпЉМCD8+ TзїЖиГЮ犯姱僺IRе∞ПйЉ†зЪДHSCи°∞иАБи°®еЮЛжИЦTreg犯姱зЪДж≤їзЦЧжХИжЮЬеЗ†дєОж≤°жЬЙељ±еУНгАВзДґиАМпЉМBM TregsзЪДињЗзїІиљђзІїжґИйЩ§дЇЖињЩзІНжЛѓжХСдљЬзФ®(еЫЊ2M, N)гАВж≠§е§ЦпЉМиљђзІїзЪДtregsеН†BM tregsзЪДе§ІйГ®еИЖпЉМеєґдЄФеЬ®еПЧдљУIRе∞ПйЉ†дЄ≠жШЊз§ЇеЗЇжШЊиСЧзЪДеҐЮжЃЦ(еЫЊ2O)еТМеЬ®HSCзФЯжАБдљНдЄ≠зЪДзІѓзіѓгАВжАїдєЛпЉМињЩдЇЫзїУжЮЬи°®жШОMHCII-TCRеПВдЄОиІ¶еПСдЇЖи°∞иАБзЪДHSCеТМBM tregдєЛйЧізЪДеПМеРСзЫЄдЇТдљЬзФ®пЉМињЩдЄОй©±еК®HSCи°∞иАБжЬЙеЕ≥гАВ
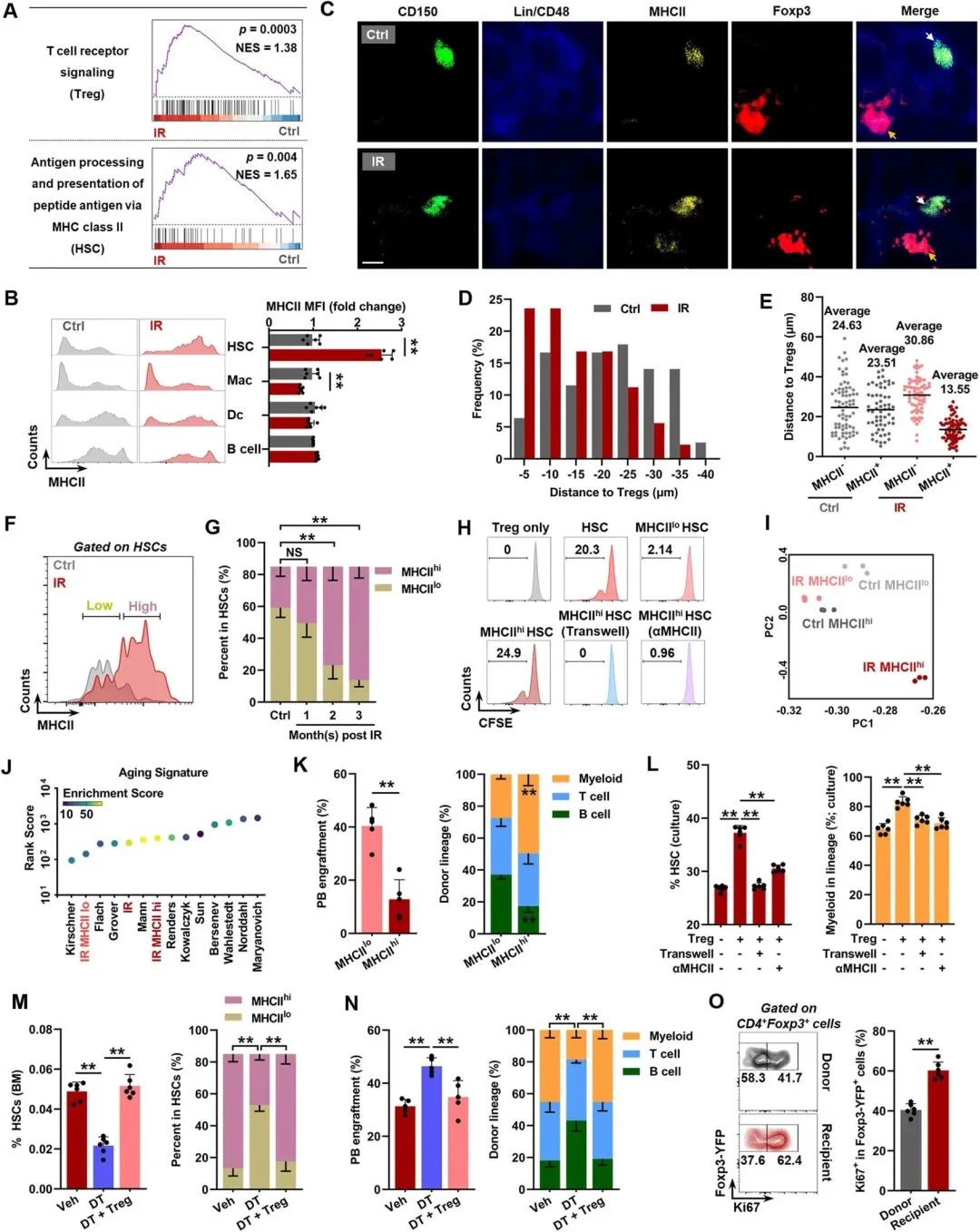
еЫЊ2
03 DNAз™БеПШеѓЉиЗіHSC MHC IIдЄКи∞Г
      
¬†¬†¬†¬†¬†¬†¬†йАЪињЗиІВеѓЯеИ∞IRе∞ПйЉ†зЪДMHCIIhi HSCжѓФMHCIIlo¬†HSCи°®зО∞еЗЇжЫіжШЊиСЧзЪДз™БеПШиіЯиНЈпЉМињЩжШѓйАЪињЗеЕ®е§ЦжШЊе≠РзїДжµЛеЇП(WESпЉЫеЫЊ3A, B)гАВзДґиАМпЉМељУTregs襀иАЧе∞љжЧґпЉМIRе∞ПйЉ†йА†и°Аеє≤зїЖиГЮдЄ≠зЪДDNAз™БеПШиіЯиНЈжШЊиСЧеЗПе∞СпЉМиАМBM TregsзЪДзїІеПСжАІиљђзІїеЗ†дєОжґИйЩ§дЇЖињЩзІНељ±еУН(еЫЊ3C, D)гАВињЩдЇЫжХ∞жНЃи°®жШОпЉМз™БеПШзІѓзіѓеПѓиГљйАЪињЗдЇІзФЯMHCIIйЩРеИґжАІжЦ∞жКЧеОЯжЭ•дњГињЫIRе∞ПйЉ†HSCдЄ≠MHCIIзЪДдЄКи∞ГпЉМжКЧеОЯзЙєеЉВжАІTregsеПѓиГљдњГињЫињЩдЇЫз™БеПШзІѓзіѓзЪДMHCIIhi HSCзЪДе≠ШжіїгАВ
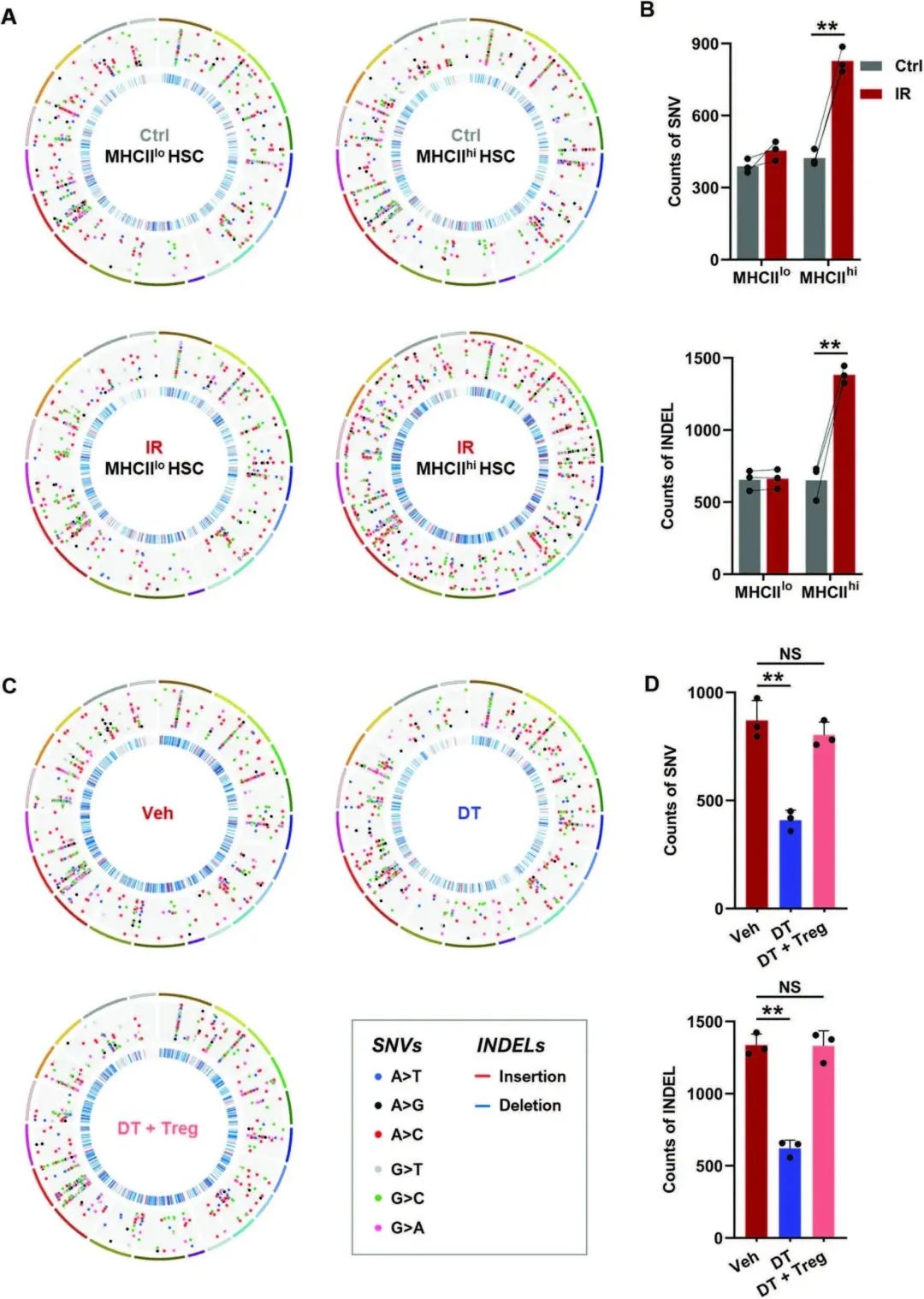
еЫЊ3
04 и°∞иАБHSCйАЪињЗCx43дЄОBM tregеїЇзЂЛеКЯиГљжАІGJs
       
¬†¬†¬†¬†¬†¬†¬†жО•дЄЛжЭ•пЉМдљЬиАЕиѓХеЫЊз°ЃеЃЪMHCIIhiеЮЛHSCжЙ©еҐЮзЪДеИЖе≠РжЬЇеИґгАВй¶ЦеЕИеИЖжЮРдЇЖIPAеѓєдњ°еПЈйАЪиЈѓзЪДжЬАйЂШеѓМйЫЖпЉМеєґж≥®жДПеИ∞GJдњ°еПЈеЬ®IRе∞ПйЉ†зЪДBM HSCеТМTregsдЄ≠йÚ襀劯зГИдЄКи∞Г(еЫЊ4A)гАВжНЃжК•йБУпЉМMHCII-TCRзЪДеПВдЄОдњГињЫдЇЖTзїЖиГЮеТМAPCдєЛйЧіGJзЪД嚥жИРгАВеЃЮйЩЕдЄКдљЬиАЕиІВеѓЯеИ∞пЉМдЄОIRе∞ПйЉ†зЪДMHCIIhiеЮЛHSCзЫЄжѓФпЉМMHCIIhiеЮЛHSCдЄ≠зЪДGJдњ°еПЈжЫіеК†жіїиЈГ(еЫЊ4B)гАВGJжШѓзФ±ињЮжО•иЫЛзЩљжЮДеїЇзЪД(Cx)гАВеЕґдЄ≠пЉМдљЬиАЕеПСзО∞Cx43/GJA1еЬ®IRе∞ПйЉ†зЪДHSC(е∞§еЕґжШѓMHCIIhi HSC)еТМtregдЄ≠еЭЗжШЊиСЧдЄФдЄУдЄАдЄКи∞Г(еЫЊ4C, D)гАВйАЪињЗеЕНзЦЂжЯУиЙ≤пЉМдљЬиАЕињШзїПеЄЄиІВеѓЯеИ∞IRе∞ПйЉ†BMдЄ≠HSCеТМtregдєЛйЧіеПѓиÚ嚥жИРеЯЇдЇОCx43зЪДGJs(еЫЊ4E)гАВеЬ®дљУе§ЦпЉМйАЪињЗйТЩйїДиЫЛзЩљ(еП™иГљйАЪињЗGJsеЬ®зїЖиГЮдєЛйЧіиљђзІї)пЉМдљЬиАЕй™МиѓБдЇЖIRе∞ПйЉ†зЪДHSCпЉМзЙєеИЂжШѓMHCIIhi¬†HSCеТМtregдєЛйЧіеїЇзЂЛдЇЖеКЯиГљжАІGJs(еЫЊF, G)пЉМеєґдЄФињЩзІНдљЬзФ®жШѓзїЖиГЮжО•иІ¶еТМеПЦеЖ≥дЇОMHCII(еЫЊ4H)гАВељУIRе∞ПйЉ†BM HSCдЄОжХ≤йЩ§Cx43зЪДиЗ™дљУTregsеЕ±еЯєеЕїжЧґпЉМйТЩйїДиЫЛзЩљиљђзІїеЗ†дєОжґИ姱(Cx43-/-пЉЫеЫЊ4HпЉЙгАВеРМжЧґпЉМCx43-/- BM TregsзЪДињЗзїІиљђзІїдЄОCx43-з≤ЊйАЪзЪДBM TregsзЫЄжѓФеЕЈжЬЙзЫЄдЉЉзЪДеЕНзЦЂжКСеИґеТМжњАжіїи°®еЮЛпЉМжЬ™иГљйАЖиљђTregиАЧе∞љеТМеѓєHSCи°∞иАБзЪДжЛѓжХСдљЬзФ®(еЫЊ4I,J)гАВињЩдЇЫзїУжЮЬи°®жШОпЉМи°∞иАБзЪДHSCеТМBM tregдєЛйЧійАЪињЗMHCII-TCRзЪДдљЬзФ®еїЇзЂЛдЇЖеЯЇдЇОCx43зЪДGJsгАВ
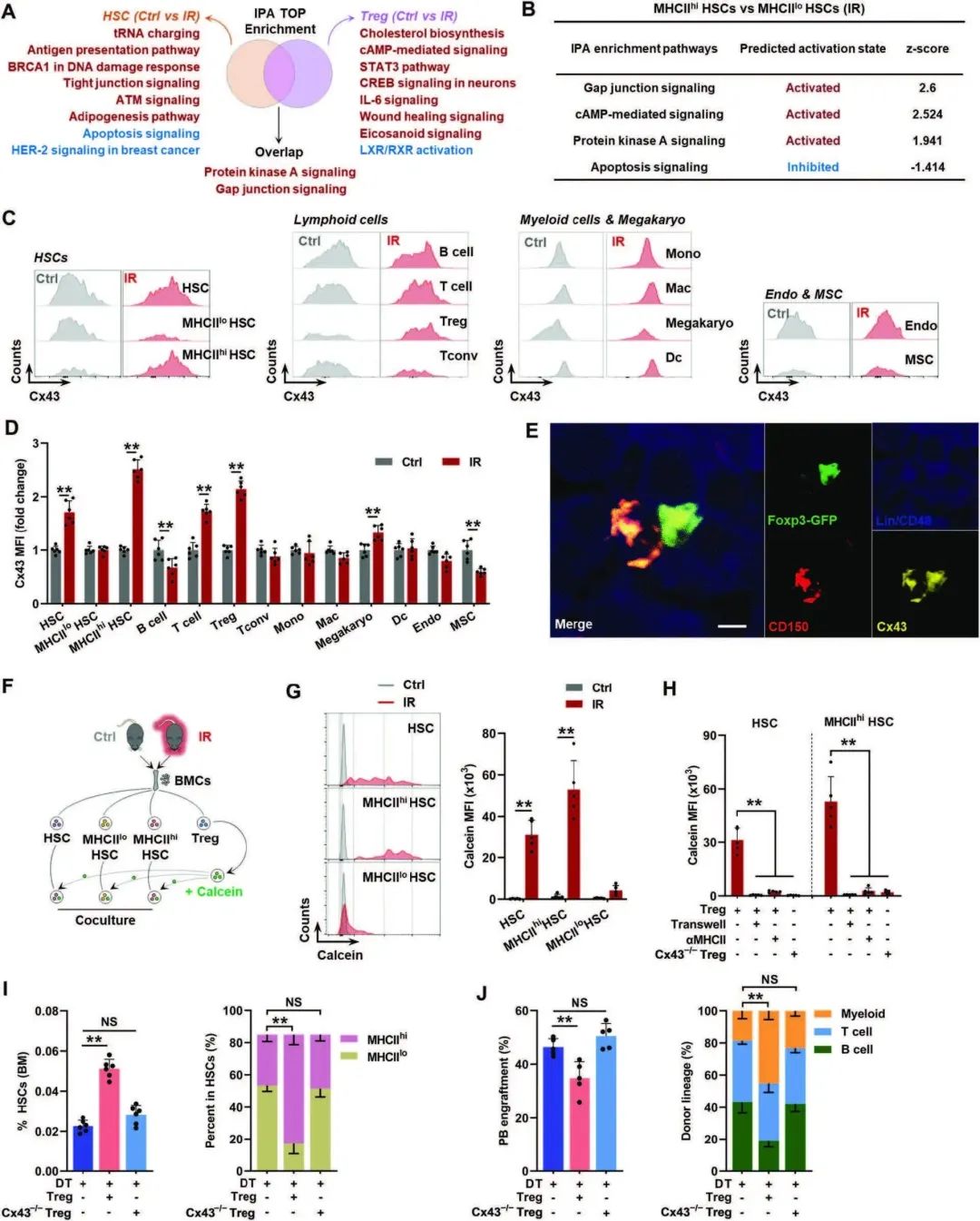
еЫЊ4
05 BM tregйАЪињЗGJsиљђзІїcAMPпЉМеЗПе∞Си°∞иАБhscзЪДеЗЛдЇ°еРѓеК®
       
¬†¬†¬†¬†¬†¬†¬†зДґеРОпЉМйАЪињЗз†Фз©ґиАБеМЦHSCеЬ®зФ®TregsеїЇзЂЛGJsжЧґзЪДзїУжЮЬгАВеЬ®жЬАеѓМйЫЖзЪДдњ°еПЈйАЪиЈѓдЄ≠пЉМдљЬиАЕж≥®жДПеИ∞еЬ®IRе∞ПйЉ†зЪДHSCдЄ≠е§ІйЗПе≠Шеܮ襀жКСеИґзЪДеЗЛдЇ°дњ°еПЈ(еЫЊ4A)гАВж≠§е§ЦпЉМMHCIIhiеЮЛHSCдЄ≠зЪДеЗЛдЇ°дњ°еПЈжѓФMHCIIloеЮЛHSCдЄ≠зЪДжЫіеПЧжКСеИґ(еЫЊ4B)пЉМжО®жЦ≠BM-TregзЫЄдЇТдљЬзФ®еЬ®HSCеЗЛдЇ°дњ°еПЈдЉ†еѓЉдЄ≠еПСжМ•дљЬзФ®гАВдЄЇдЇЖжФѓжМБињЩдЄАеПСзО∞пЉМе∞љзЃ°IRе∞ПйЉ†MHCIIhiеТМMHCIIloйА†и°Аеє≤зїЖиГЮдЄ≠еЗЛдЇ°зїЖиГЮзЪДжѓФдЊЛеЬ®з®≥жАБдЄЛзЫЄељУ(и°•еЕЕеЫЊ5a)пЉМз°ЉзГЈеИЖжЮРжШЊз§ЇпЉМIRе∞ПйЉ†еѓєBIMпЉИеЫЊ5AпЉЙеТМBIDзЪДеЗЛдЇ°еРѓеК®йЗПињЬдљОдЇОMHCIIloгАВж≠§е§ЦпЉМйА†и°Аеє≤зїЖиГЮпЉМзЙєеИЂжШѓMHCIIhiйА†и°Аеє≤зїЖиГЮеЬ®IRе∞ПйЉ†дЄ≠зЪДжКЧеЗЛдЇ°иГљеКЫжШѓBM-TregsдЊЭиµЦжАІзЪД(еЫЊ5B)гАВеЬ®дљУе§ЦпЉМжЭ•иЗ™IRе∞ПйЉ†зЪДMHCIIhi HSCзЪДеЗЛдЇ°еРѓеК®пЉМиАМдЄНжШѓMHCIIlo HSCпЉМеЬ®е≠ШеЬ®иЗ™дљУBM TregsзЪДжГЕеЖµдЄЛ襀еЗПеЉ±(еЫЊ5C)пЉМеєґдЄФињЩзІНжХИеЇФжШѓзїЖиГЮжО•иІ¶еТМMHCIIдЊЭиµЦзЪД(еЫЊ5D)гАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМдљЬиАЕињШиІВеѓЯеИ∞Cx43еѓєдЇОIRе∞ПйЉ†MHCIIhi HSCзЪДдљУеЖЕжКЧеЗЛдЇ°жШѓењЕдЄНеПѓе∞СзЪД(еЫЊ5B)еТМз¶їдљУ(еЫЊ5D)пЉМи°®жШОGJsзЪДеПВдЄОгАВGJsйАЪињЗе∞ПдЇО1200daзЪДеПѓжЇґжАІеЫ†е≠РзЪДдЉ†йАТи∞ГиКВйВїињСзїЖиГЮзЪДиГЮеЖЕдњ°еПЈдЉ†еѓЉгАВRNA-seqжШЊз§ЇпЉМзФ±жђ°зЇІдњ°дљњcAMPжњАжіїзЪДPKAдњ°еПЈеЬ®IRе∞ПйЉ†зЪДBM HSCsеТМtregsдЄ≠йÚ襀劯зГИжњАжії(еЫЊ4A)пЉМеєґдЄФеЬ®IRе∞ПйЉ†зЪДMHCIIhi HSCдЄ≠жњАжіїжѓФMHCIIlo HSCдЄ≠жЫіжШОжШЊ(еЫЊ4B)гАВдЄОзЫЄеЕ≥жК•йБУдЄАиЗіпЉМдљЬиАЕдєЯеПСзО∞IRе∞ПйЉ†BM TregsдЄ≠cAMPж∞іеє≥зЪДеѓМйЫЖеТМжШЊиСЧеНЗйЂШ(еЫЊ5E)гАВcAMP-protein kinase A (PKA)дњ°еПЈж≠£и∞ГжОІHSCе≠ШжіїпЉМжПРз§ЇTregsеПѓиГљйАЪињЗGJsе∞ЖcAMPиљђзІїеИ∞и°∞иАБзЪДHSCдЄ≠пЉМдњГињЫеЕґе≠ШжіїгАВеЃЮйЩЕдЄКпЉМдљЬиАЕжµЛйЗПдЇЖIRе∞ПйЉ†MHCIIhi¬†HSCдЄ≠cAMPж∞іеє≥гАБPKAжњАйЕґжіїжАІеПКеЕґдЄЛжЄЄCREBжіїжАІзЪДжШЊиСЧеҐЮеК†(еЫЊF-H)пЉМеєґдЄФcAMP-PKAдњ°еПЈзЪДињЗеЇ¶жњАжіїдЊЭиµЦдЇОBM TregsдЄ≠Cx43зЪДи°®иЊЊ(еЫЊ5I)гАВзДґиАМпЉМйАЙжЛ©жАІжКСеИґеЙВH89еѓєPKAзЪДжКСеИґеЗ†дєОжґИйЩ§дЇЖз±їдЉЉBM TregsеѓєIRе∞ПйЉ†MHCIIhi HSCзЪДдњГе≠ШжіїдљЬзФ®(еЫЊ5J)гАВдЄЇдЇЖињЫдЄАж≠•й™МиѓБињЩдЄАеБЗиЃЊпЉМдљЬиАЕдљњзФ®Alexa Fluor 488ж†ЗиЃ∞зЪДcAMP (488-cAMP)иЈЯиЄ™дЇЖcAMPзЪДиљђзІїгАВе¶ВеЫЊжЙАз§ЇпЉМBM TregsињЕйАЯиАМжШЊиСЧеЬ∞е∞Ж488-cAMPиљђзІїеИ∞IRе∞ПйЉ†зЪДMHCIIhi HSCиАМдЄНжШѓMHCIIlo HSC(еЫЊ5K)пЉМеєґдЄФињЩзІНдљЬзФ®дЊЭиµЦдЇОзїЖиГЮжО•иІ¶гАБMHCIIеТМCx43(еЫЊ5L)гАВињЩдЇЫжХ∞жНЃи°®жШОпЉМBM TregsйАЪињЗGJsиљђзІїcAMPдї•еЗПе∞Си°∞иАБHSCзЪДеЗЛдЇ°еРѓеК®гАВ
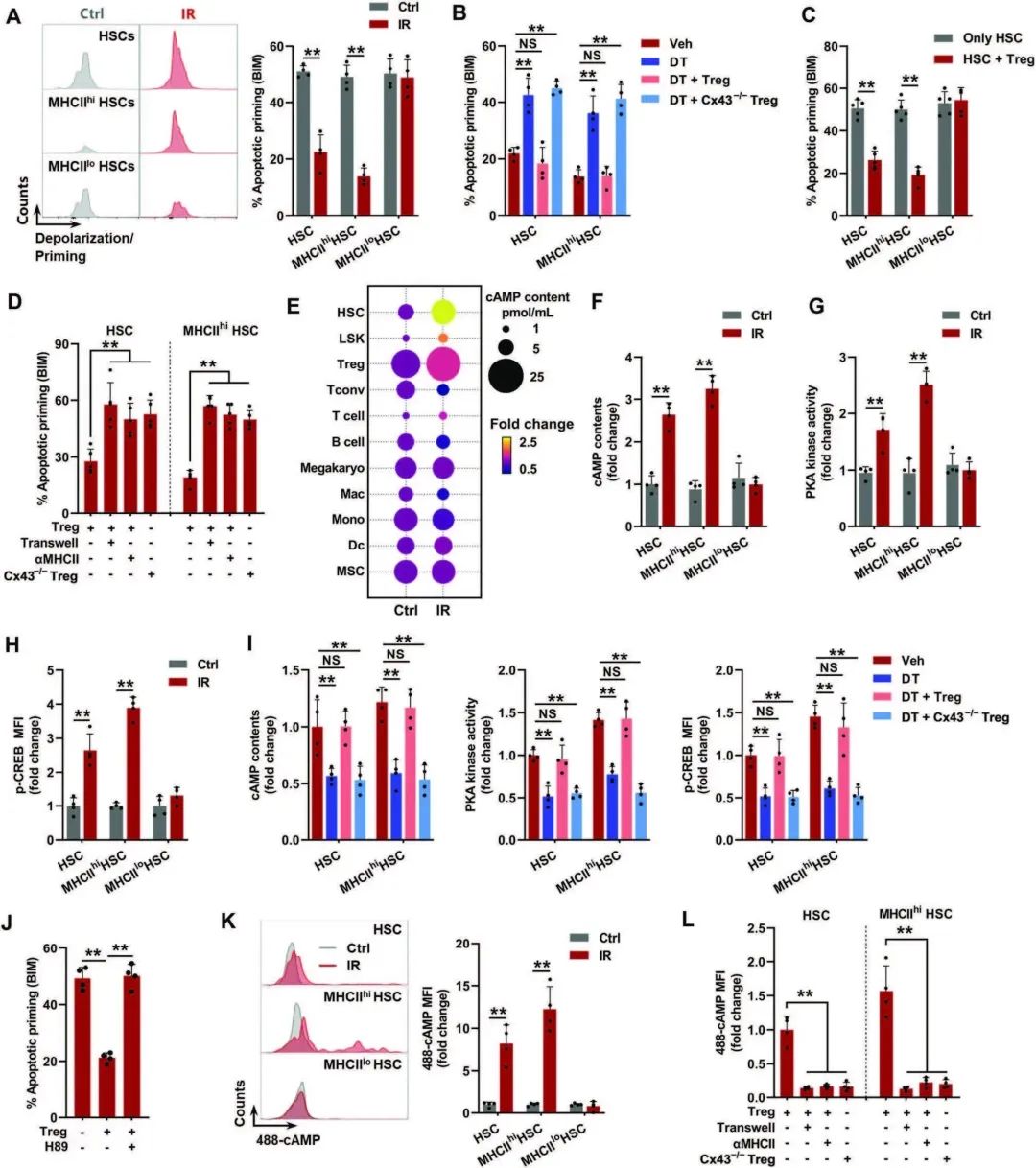
06¬†HSC-tregеПМеРСзЫЄдЇТдљЬзФ®дЄОHSCзФЯзРЖиАБеМЦжЬЙеЕ≥
      
¬†¬†¬†¬†¬†¬†¬†зФЯзРЖжАІHSCи°∞иАБзЪДеП¶дЄАдЄ™зЙєеЊБжШѓDNAз™БеПШзІѓзіѓпЉМињЩзІНзІѓзіѓеЬ®дЄ≠еєіеЊИжШОжШЊгАВжЬЙиґ£зЪДжШѓпЉМHSCи°∞иАБи°®еЮЛ(еЫЊ6A)еТМBM TregsзЪДеЕЛйЪЖжЙ©еҐЮ(еЫЊ6B, C)дїОдЄ≠еєіеИ∞иАБеєіж∞іеє≥еЈ≤зїПеЊИжШОжШЊпЉМдЉійЪПзЭАDNAз™БеПШзЪДжА•еЙІзІѓзіѓпЉМзЙєеИЂжШѓеЬ®MHCIIhi HSCдЄ≠(еЫЊ6D)гАВдЄОIRе∞ПйЉ†з±їдЉЉпЉМдљЬиАЕдєЯеПСзО∞дЇЖдЄ≠еєіе∞ПйЉ†HSCеЃ§дЄ≠MHCIIhi HSCзЪДињЗеЇ¶дї£и°®(еЫЊ6E)гАВ
¬†¬†¬†¬†¬†¬†¬†еЫ†ж≠§пЉМдЄОtregзЪДзЛђзЙєйВїжО•жАІ(еЫЊ6F, G)пЉМ GJдЄОTregsзЪД嚥жИР(еЫЊ6H)еТМcAMP-PKAдњ°еПЈињЗеЇ¶жњАжії(еЫЊ6I)пЉМдї•еПКеЗЛдЇ°еРѓеК®еЗПе∞С(еЫЊ6JпЉЙпЉМеЬ®дЄ≠еєідЄ≠еєіе∞ПйЉ†зЪДйА†и°Аеє≤зїЖиГЮдЄ≠пЉМзЙєеИЂжШѓMHCIIhiдЄ≠пЉМиІВеѓЯеИ∞еЗЛдЇ°еРѓеК®зЪДеЗПе∞СгАВињЩдЇЫжФєеПШдєЯеЬ®иљђељХзїДе≠¶ж∞іеє≥дЄКеЊЧеИ∞дЇЖиѓБеЃЮпЉИеЫЊ6KпЉЙгАВеЬ®иљђељХзїДе≠¶еТМеКЯиГљж∞іеє≥дЄКпЉМдЄ≠еєіе∞ПйЉ†зЪДMHCIIhi HSCи°®зО∞еЗЇдЄОиАБеєіе∞ПйЉ†зЫЄдЉЉзЪДи°∞иАБзЙєеЊБеТМи∞±з≥їеБПеЈЃ(еЫЊ6L, M)гАВзДґиАМпЉМTreg犯姱жШЊиСЧеЗПиљїдЇЖдЄ≠еєіе∞ПйЉ†зЪДHSCи°∞иАБи°®еЮЛ(еЫЊ6N-P)пЉМиѓБжШОHSC-tregеПМеРСзЫЄдЇТдљЬзФ®еПВдЄОHSCзФЯзРЖжАІиАБеМЦгАВ
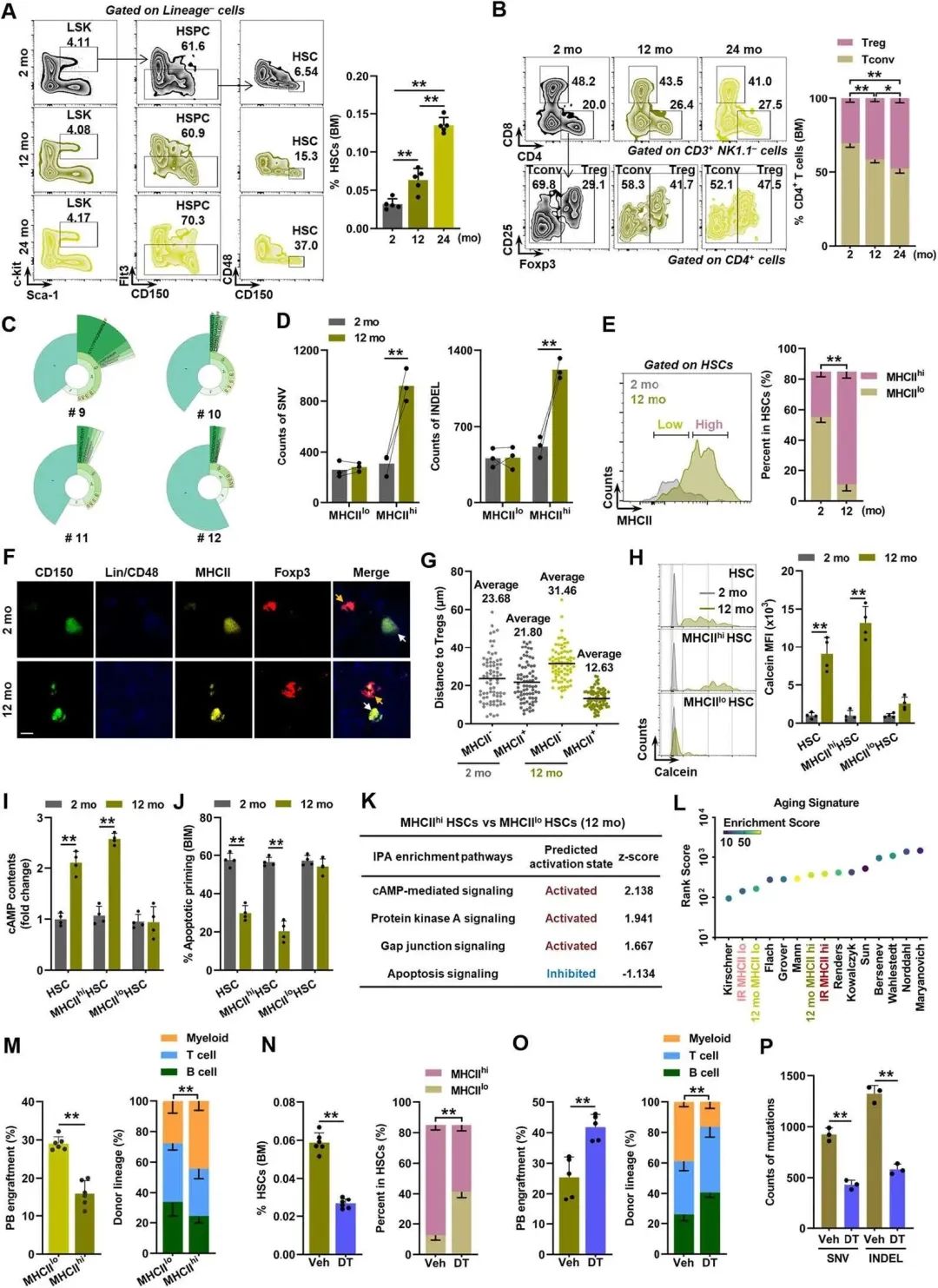
еЫЊ6
07 йАЪињЗеє≤йҐДиАБеМЦHSC – tregзЫЄдЇТдљЬзФ®йҐДйШ≤HSCи°∞иАБ
¬† ¬† ¬† жЬАеРОпЉМдљЬиАЕиѓДдЉ∞дЇЖз†Фз©ґзїУжЮЬзЪДиљђеМЦжљЬеКЫгАВзФ±дЇОдЇЇжЇРжКЧhCD25жКЧдљУ(daclizumab)еПѓиОЈеЊЧеєґеєњж≥ЫеЇФзФ®дЇОдЄіеЇКзОѓеҐГпЉМдљЬиАЕй¶ЦеЕИжµЛиѓХдЇЖжКЧйЉ†CD25 (ќ±CD25)еЬ®HSCи°∞иАБдЄ≠жґИиАЧtregзЪДж≤їзЦЧжљЬеКЫ(еЫЊ7A)гАВќ±CD25зїЩиНѓжШЊиСЧеЗПе∞СIRе∞ПйЉ†дЄ≠BM tregзЪДжХ∞йЗПпЉМиАМдЄНеЉХиµЈCD8+ TзїЖиГЮзЪДжШЊиСЧжіїеМЦгАВеРМжЧґпЉМќ±CD25зїЩиНѓеРОпЉМIRе∞ПйЉ†MHCIIhi HSCжЙ©еҐЮжШОжШЊеЗПеЉ±(еЫЊ7B)пЉМеРМжЧґжШЊиСЧеЗПиљїдЇЖDNAз™БеПШиіЯиНЈ(еЫЊ7CгАБD)пЉМжКСеИґдЇЖcAMP-PKAдњ°еПЈпЉМеҐЮеЉЇдЇЖHSCзЪДеЗЛдЇ°еРѓеК®гАВ
¬†¬†¬†¬†¬†¬†жЬАеРОпЉМќ±CD25еѓєIRе∞ПйЉ†HSCзЪДи°∞иАБи°®еЮЛжЬЙжШОжШЊзЪДжФєеЦД(еЫЊ7E)гАВGap27жШѓдЄАзІНиВљпЉМеЬ®дљУеЖЕеЈ≤襀иѓБжШОйАВеРИеє≤жЙ∞еЯЇдЇОCx43зЪДGJsзЪД嚥жИРеТМз®≥еЃЪжАІгАВеЬ®дљУе§ЦпЉМдљЬиАЕиѓБеЃЮGap27жЬЙжХИйШїжЦ≠дЇЖGJдїЛеѓЉзЪДcAMPеЬ®IRе∞ПйЉ†BM HSCеТМtregдєЛйЧізЪДиљђзІїгАВзЫЄеЇФзЪДпЉМGAP27еЬ®дљУеЖЕжШЊиСЧзЉУиІ£дЇЖйА†и°Аеє≤зїЖиГЮcAMP-PKAдњ°еПЈзЪДжњАжіїеТМеЗЛдЇ°жКµжКЧпЉМдїОиАМеЗПиљїдЇЖIRе∞ПйЉ†йА†и°Аеє≤зїЖиГЮзЪДи°∞иАБи°®еЮЛ(еЫЊ7B-E)гАВеРМж†ЈпЉМзїЩиНѓќ±CD25жИЦGAP27еПѓжШЊиСЧжМљжХСдЄ≠еєіе∞ПйЉ†йА†и°Аеє≤зїЖиГЮзЪДжЧ©и°∞и°®еЮЛ(еЫЊ7F-J)гАВеЫ†ж≠§пЉМз≥їзїЯзїЩиНѓќ±CD25жИЦGAP27жЬЙжЬЫйҐДйШ≤HSCи°∞иАБпЉМиЗ≥е∞СйГ®еИЖеє≤йҐДдЇЖиАБеМЦзЪДHSC- tregзЫЄдЇТдљЬзФ®гАВ
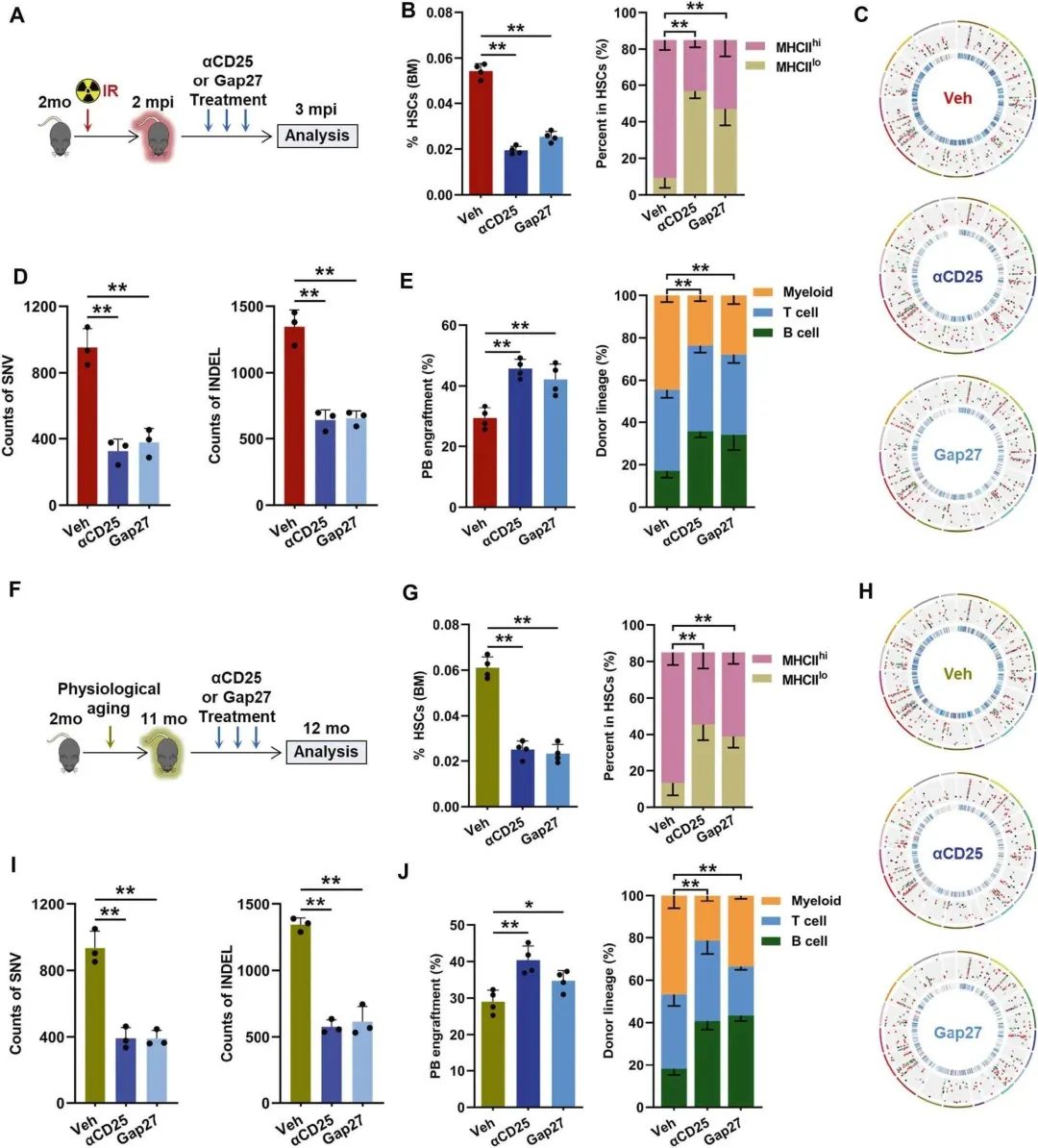
еЫЊ7¬†
зїУиЃЇ
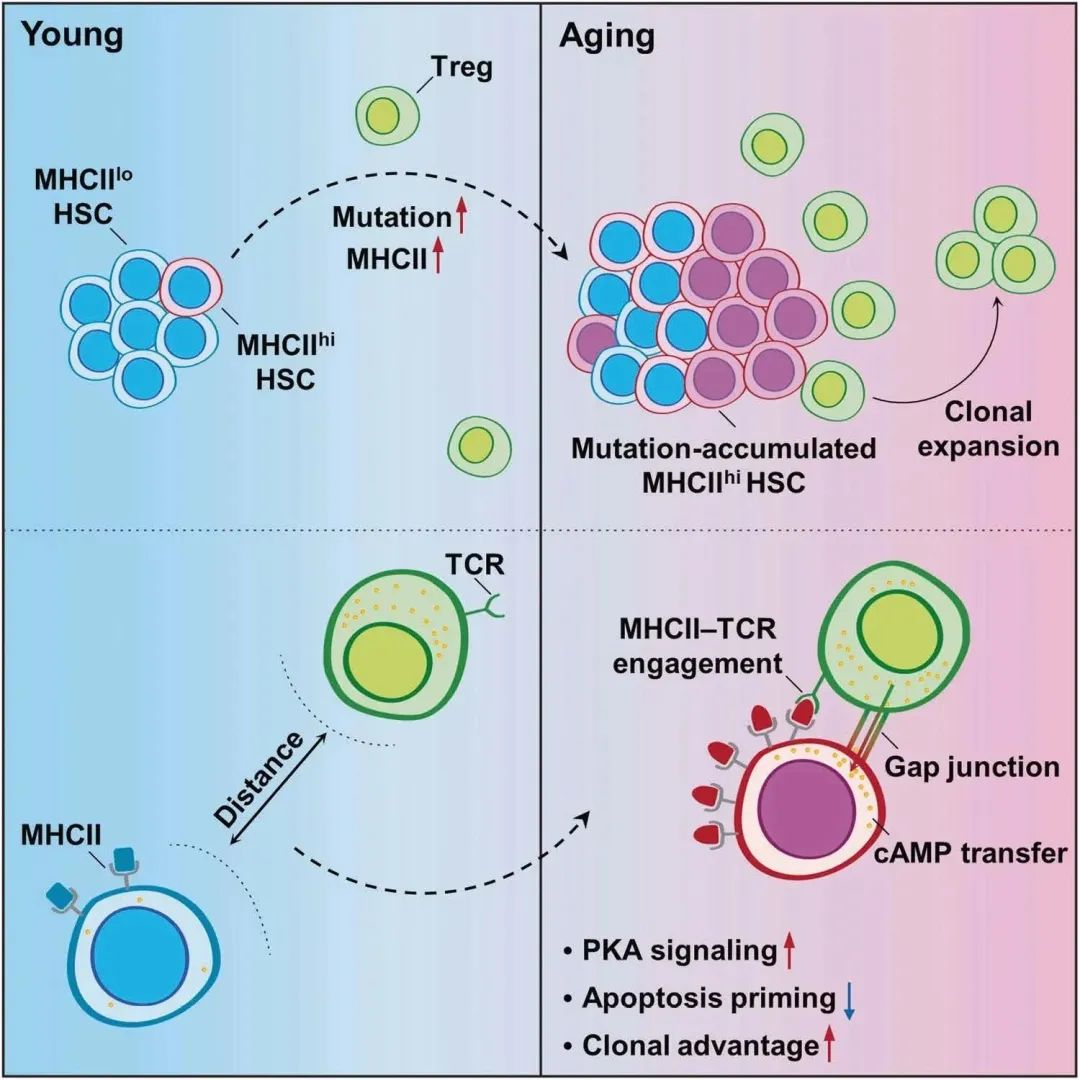
еЫЊ8
¬†¬†¬†¬†¬†¬†BM TregsеЬ®HSCи°∞иАБдЄ≠зЪДи∞ГиКВдљЬзФ®з§ЇжДПеЫЊпЉИеЫЊ8пЉЙзЙєеМЦй™®йЂУ(BM)еЊЃзОѓеҐГпЉМзІ∞дЄЇHSCзФЯжАБдљНпЉМйАЪињЗзїЖиГЮзїУеРИжИЦеИЖж≥МеЫ†е≠РжИЦзЙ©зРЖзЫЄдЇТдљЬзԮ嚥еЉПзЪДзїЖиГЮйЧідњ°еПЈзїіжМБHSC汆зЪДе§Іе∞ПеТМеКЯиГљгАВ
¬†¬†¬†¬†¬†¬†жАїдєЛпЉМжЬђз†Фз©ґеЗЄжШЊеЕНзЦЂзїЖиГЮеПКиЖЬиЫЛзЩљеЬ®HSCи°∞иАБдЄ≠зЪДеЕ≥йФЃдљЬзФ®пЉМдЄЇеЃЮзО∞жПРеЙНйҐДйШ≤еТМж≤їзЦЧHSCи°∞иАБжПРдЊЫдЇЖзРЖиЃЇеЯЇз°АеТМжЦ∞з≠ЦзХ•гАВжЬ™жЭ•йАЪињЗз≥їзїЯйШРжШОдЄНеРМеЕНзЦЂзїЖиГЮдЇЪзЊ§дЄОеє≤зїЖиГЮзЪДдЇТеК®пЉМеЉАеПСйЭґеРСеє≤йҐДHSC-TregиљізЪДжЦ∞иНѓзЙ©пЉМжЬЙжЬЫжКСеИґзїДзїЗеє≤зїЖиГЮзЪДеК†йАЯи°∞иАБпЉМеїґзЉУзЫЄеЕ≥зЦЊзЧЕзЪДеПСзФЯгАВ
еПВиАГжЦЗзМЃ
Liao W, Liu C, Yang K, Chen J, Wu Y, Zhang S, Yu K, Wang L, Ran L, Chen M, Chen F, Xu Y, Wang S, Wang F, Zhang Q, Zhao J, Ye L, Du C, Wang J. Aged hematopoietic stem cells entrap regulatory T cells to create a prosurvival microenvironment. Cell Mol Immunol. 2023 Oct;20(10):1216-1231. doi: 10.1038/s41423-023-01072-3. Epub 2023 Aug 30. PMID: 37644165; PMCID: PMC10541885.
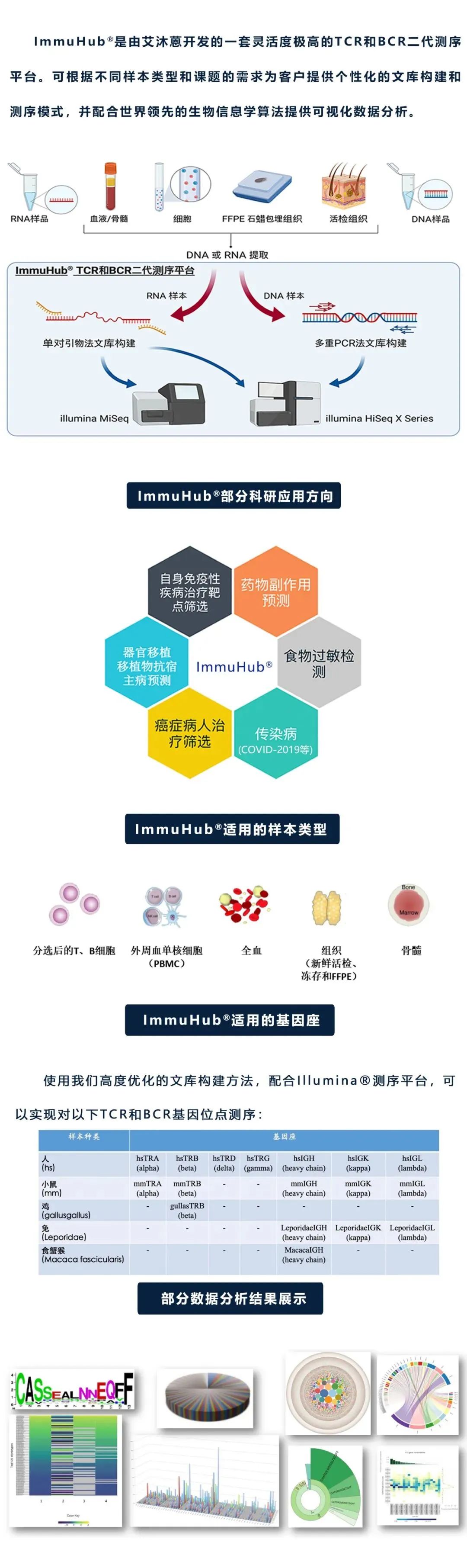

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ |TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ

