ињСеЗ†еєіпЉМдє≥иЕЇзЩМжВДжВДвАЬжЛФе∞ЦвАЭпЉМеЈ≤жИРдЄЇеЫ∞жЙ∞е•≥жАІзЪДй¶ЦдљНзЩМзЧЗгАВжИСеЫљеє≥еЭЗжѓП76зІТпЉМе∞±жЬЙ1дЇЇз°ЃиѓКдє≥иЕЇзЩМпЉБеЕґдЄ≠дЄЙйШіжАІдє≥иЕЇзЩМпЉИTriple-Negative Breast Cancer, TNBCпЉЙжШѓе§НеПСзОЗеТМж≠їдЇ°зОЗжЬАйЂШзЪДдє≥иЕЇзЩМдЇЪеЮЛгАВзЫЃеЙНпЉМжњАзі†зЦЧж≥ХеТМйЭґеРСзЦЧж≥Хеѓєж≤їзЦЧTNBCеЭЗжЧ†жХИпЉМдЄїи¶Бдї•дЉ†зїЯеМЦзЦЧдљЬдЄЇдЄїи¶Бж≤їзЦЧжЙЛжЃµпЉМдљЖжХИжЮЬдЄНзФЪзРЖжГ≥гАВ
иЩљзДґзЩМзЧЗеЕНзЦЂж≤їзЦЧеЈ≤ињЫеЕ•ењЂйАЯеПСе±ХжЧґжЬЯпЉМTNBCзЪДеЕНзЦЂж≤їзЦЧеНідЄЊж≠•зїіиЙ∞гАВжЧ©жЬЯIMpassion 130дЄіеЇКиѓХй™Ми°®жШОпЉМanti-PD-L1жКЧдљУйШњжЫњеИ©зП†еНХжКЧпЉИAtezolizumabпЉЙиБФеРИзЩљиЫЛзЩљзїУеРИеЮЛзіЂжЭЙйЖЗпЉИNab-paclitaxelпЉЙиГље§ЯжШЊиСЧйЩНдљОPD-L1+TNBCжВ£иАЕзЪДжЧ†зЦЊзЧЕињЫе±ХжИЦж≠їдЇ°й£ОйЩ©гАВдљЖињСжЬЯIMpassion 131дЄіеЇКиѓХй™Ми°®жШОпЉМйШњжЫњеИ©зП†еНХжКЧиБФеРИзіЂжЭЙйЖЗеНіжЧ†ж≥ХдљњTNBCжВ£иАЕиОЈзЫКгАВ
дЄНеРМдЄіеЇКиѓХй™МзЪДзїУжЮЬеЈЃеЉВжПРз§ЇпЉМдЄНеРМзЪДеМЦзЦЧиНѓзЙ©еПѓиГљдЉЪеѓЉиЗідЄНеРМзЪДиВњзШ§еЊЃзОѓеҐГзЙєеЊБпЉМињЫиАМељ±еУНеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВзЪДж≤їзЦЧжХИжЮЬгАВз≥їзїЯиІ£жЮРзФ®иНѓеЙНеРОзЪДиВњзШ§еЊЃзОѓеҐГеПШеМЦжШѓзРЖиІ£ељУеЙНеЕНзЦЂж≤їзЦЧеТМеМЦзЦЧиНѓзЙ©зЪДдљЬзФ®жЬЇеИґгАБдї•еПКжПРйЂШTNBCжХідљУж≤їзЦЧжХИжЮЬзЪДеЕ≥йФЃгАВ¬†

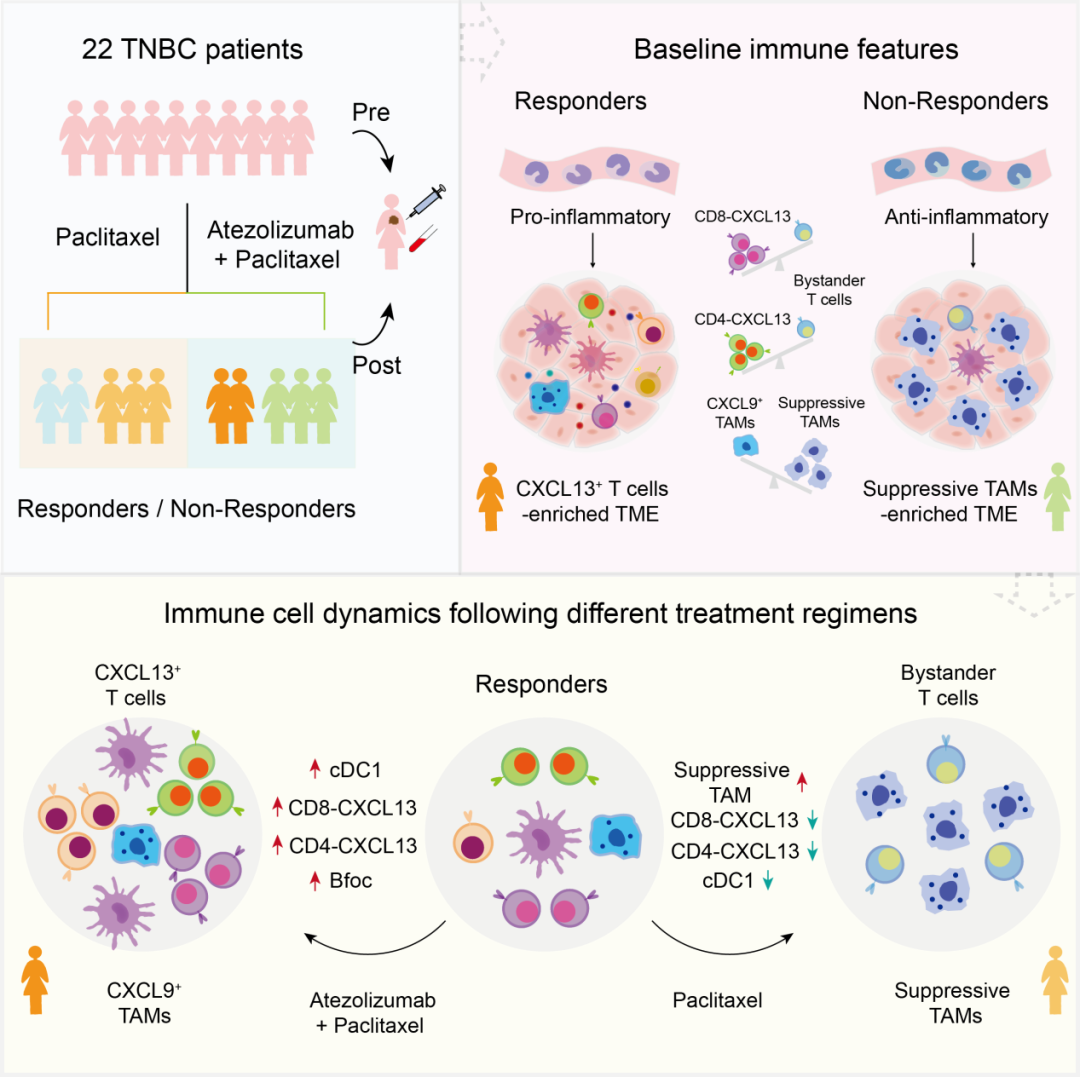
йАЪињЗжѓФиЊГиБФеРИзФ®иНѓзїДдЄНеРМеУНеЇФжВ£иАЕзЪДиВњзШ§еПКе§ЦеС®и°АеЕНзЦЂзїЖиГЮзЪДзїДжИРеЈЃеЉВпЉМз†Фз©ґдЇЇеСШеПСзО∞еУНеЇФжВ£иАЕзЪДиВњзШ§еЊЃзОѓеҐГеѓМйЫЖдЇЖдЄ§зЊ§йЂШи°®иЊЊCXCL13зЪДTзїЖиГЮ(CD8-CXCL13еТМCD4-CXCL13)пЉМињЩдЄ§зЊ§зїЖиГЮеРМжЧґйЂШи°®иЊЊTзїЖиГЮжѓТжАІеТМвАЬиАЧзЂ≠вАЭзЫЄеЕ≥еЯЇеЫ†гАВдЄЇдЇЖињЫдЄАж≠•з≤Њз°ЃеИїзФїдЄНеРМеЕНзЦЂзїЖиГЮзЪДзїДжИРжИРеИЖеТМжѓФдЊЛеПШеМЦдЄОж≤їзЦЧжХИжЮЬзЪДеЕ≥иБФпЉМз†Фз©ґдЇЇеСШиЃЊиЃ°дЇЖдЄ§дЄ™жМЗжХ∞пЉЪвАЬйҐДжµЛжМЗжХ∞вАЭеТМвАЬж≤їзЦЧжМЗжХ∞вАЭгАВйАЪињЗвАЬйҐДжµЛжМЗжХ∞вАЭеТМвАЬж≤їзЦЧжМЗжХ∞вАЭеИЖжЮРпЉМз†Фз©ґдЇЇеСШеПСзО∞жЫійЂШеЯЇзЇњж∞іеє≥зЪДCD8-CXCL13еТМCD4-CXCL13иГље§ЯйҐДжµЛжЫіе•љзЪДеЕНзЦЂж≤їзЦЧеУНеЇФпЉМдЄФињЩдЄ§зЊ§CXCL13+TзїЖиГЮеЬ®еУНеЇФжВ£иАЕдЄ≠зїПињЗиБФеРИзФ®иНѓеРОзїЖиГЮжѓФдЊЛжШЊиСЧеҐЮеК†гАВ
ж≠§е§ЦпЉМз†Фз©ґдЇЇеСШеПСзО∞еУНеЇФжВ£иАЕзЪДиВњзШ§еЊЃзОѓеҐГдЄ≠еѓМйЫЖдЇЖдЄ§зЊ§йЂШи°®иЊЊCXCL9еТМCXCL10зЪДдњГзВОжАІеЈ®еЩђзїЖиГЮпЉМдЄФињЩдЄ§зЊ§дњГзВОжАІеЈ®еЩђзїЖиГЮдЄОCXCL13+TзїЖиГЮе≠ШеЬ®жШЊиСЧж≠£зЫЄеЕ≥гАВCXCL9еТМCXCL10иГље§ЯеПВдЄОTзїЖиГЮжЛЫеЛЯпЉМиАМдњГзВОжАІеЈ®еЩђзїЖиГЮзЪДзЙєеЊБеЯЇеЫ†еПЧеИ∞IFNGеТМTNFдњ°еПЈи∞ГжОІпЉМи°®жШОеПСжМ•жЭАдЉ§еКЯиГљзЪДCXCL13+¬†TзїЖиГЮдЄОйЂШи°®иЊЊCXCL9еТМCXCL10зЪДдњГзВОжАІеЈ®еЩђзїЖиГЮдєЛйЧіе≠ШеЬ®ж≠£еПНй¶Идњ°еПЈгАВдЄОдєЛзЫЄеПНпЉМдЄНеУНеЇФжВ£иАЕзЪДиВњзШ§еЊЃзОѓеҐГдЄ≠еЗ†дєОж£АжµЛдЄНеИ∞CXCL13+¬†TзїЖиГЮпЉМдљЖеѓМйЫЖдЇЖе§ІйЗПеПСжМ•еЕНзЦЂжКСеИґеКЯиГљзЪДеЈ®еЩђзїЖиГЮгАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМз†Фз©ґдЇЇеСШеПСзО∞еУНеЇФжВ£иАЕзЪДе§ЦеС®и°АеНХж†ЄзїЖиГЮи°®зО∞еЗЇдњГзВОзЙєеЊБпЉМиАМдЄНеУНеЇФжВ£иАЕзЪДе§ЦеС®и°АеНХж†ЄзїЖиГЮи°®зО∞еЗЇжКЧзВОзЙєеЊБпЉМжПРз§Їе§ЦеС®и°АиГље§ЯеЬ®дЄАеЃЪз®ЛеЇ¶дЄКеПНеЇФиВњзШ§еЊЃзОѓеҐГзЙєеЊБгАВ¬†
иВњзШ§еЊЃзОѓеҐГжШѓдЄАдЄ™е§НжЭВзЪДзФЯжАБз≥їзїЯпЉМеЕґдЄ≠еЫЇжЬЙеЕНзЦЂеТМйАВеЇФжАІеЕНзЦЂзїЖиГЮгАБеЯЇиі®зїЖиГЮгАБзЩМзїЖиГЮеПКеЕґзЫЄдЇТдљЬзФ®пЉМжЮДжИРз≤ЊзїЖзЪДи∞ГиКВзљСзїЬпЉМеЕ±еРМеЖ≥еЃЪзЩМзЧЗзЪДеПСзФЯеТМеПСе±ХгАВиЩљзДґTзїЖиГЮжШѓељУеЙНиВњзШ§еЕНзЦЂз†Фз©ґзЪДйЗНзВєзїЖиГЮз±їеЮЛпЉМеЕґдїЦз±їеЮЛзЪДеЕНзЦЂзїЖиГЮдЇ¶еПѓйАЪињЗи∞ГжОІдљЬзФ®жИЦдЄОTзїЖиГЮдЇТдљЬпЉМељ±еУНеЕНзЦЂж≤їзЦЧжХИжЮЬгАВ
йАЪињЗз≥їзїЯеИїзФїеЕНзЦЂзїЖиГЮзЪДжѓФдЊЛзїДжИРеПКеК®жАБеПШеМЦпЉМз†Фз©ґдЇЇеСШеПСзО∞пЉМBзїЖиГЮе∞§еЕґжШѓжї§ж≥°BзїЖиГЮпЉМжШЊиСЧеѓМйЫЖеЬ®еУНеЇФжВ£иАЕзЪДиВњзШ§еЊЃзОѓеҐГдЄ≠пЉМдЄФеЕґеЬ®еЕНзЦЂж≤їзЦЧеРОжШЊиСЧеҐЮеК†гАВињЫдЄАж≠•йАЪињЗзЫЄеЕ≥жАІеИЖжЮРеПКйЕНдљУ-еПЧдљУдЇТдљЬеѓєеЕ±и°®иЊЊеИЖжЮРпЉМз†Фз©ґдЇЇеСШеПСзО∞жї§ж≥°BзїЖиГЮдЄОCXCL13+¬†TзїЖиГЮжШЊиСЧж≠£зЫЄеЕ≥дЄФе≠ШеЬ®зЫЄдЇТдљЬзФ®гАВж≠§е§ЦпЉМеЯЇдЇОеНХзїЖиГЮж∞іеє≥зЪДзїЖиГЮзїДжИРеТМTCGAеЕђеЕ±жХ∞жНЃзЪДзЙєеЊБеЯЇеЫ†и°®иЊЊпЉМз†Фз©ґдЇЇеСШеПСзО∞cDC1дЄОCXCL13+¬†TзїЖиГЮжШЊиСЧж≠£зЫЄеЕ≥пЉМдЄФcDC1еЬ®еЕНзЦЂж≤їзЦЧдљЬзФ®дЄЛжШЊиСЧеҐЮеК†пЉМжЪЧз§ЇcDC1еПѓиГљеПВдЄОCXCL13+TзїЖиГЮзЪДжњАжіїгАВ¬†
йАЪињЗжѓФиЊГеМЦзЦЧзїДеТМиБФеРИзФ®иНѓзїДеЕНзЦЂзїЖиГЮзЪДеК®жАБеПШеМЦпЉМз†Фз©ґдЇЇеСШеПСзО∞дЄОиБФеРИзФ®иНѓзЫЄеПНпЉМзіЂжЭЙйЖЗеНХиНѓеМЦзЦЧжЦєж°ИиГље§ЯжШЊиСЧйЩНдљОеУНеЇФжВ£иАЕиВњзШ§еЊЃзОѓеҐГдЄ≠зЪДCXCL13+¬†TзїЖиГЮпЉМеєґеѓЉиЗіеЕЈжЬЙеЕНзЦЂжКСеИґеКЯиГљзЪДеЈ®еЩђзїЖиГЮеЬ®иВњзШ§еЊЃзОѓеҐГдЄ≠еѓМйЫЖгАВдЄКињ∞еПСзО∞и°®жШОпЉМзіЂжЭЙйЖЗеМЦзЦЧжЦєж°ИеПѓиГљдЉЪеЙКеЉ±ж†ЄењГжКЧиВњзШ§еЕНзЦЂзїЖиГЮпЉМиАМеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВеИЩиГље§ЯжШЊиСЧеҐЮеК†ж†ЄењГжКЧиВњзШ§еЕНзЦЂзїЖиГЮпЉМжПРз§ЇзіЂжЭЙйЖЗеМЦзЦЧжЦєж°ИдЄОйШњжЫњеИ©зП†еНХжКЧиБФеРИеЇФзФ®жЧґпЉМдЉЪељ±еУНanti-PD-L1жКЧдљУеѓєTNBCжВ£иАЕзЪДж≤їзЦЧжХИжЮЬгАВ
дїАдєИжШѓImmuHub¬ЃжКАжЬѓпЉЯ
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄзФ±зЊОеЫљиКЭеК†еУ•е§Іе≠¶зІСз†ФеЫҐйШЯеЫЮеЫљеИЫеКЮпЉМжШѓдЄАеЃґдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВиЙЊж≤РиТљзЂЩеЬ®йАВеЇФжАІеЕНзЦЂз≥їзїЯз†Фз©ґзЪДжЬАеЙНж≤њпЉМиЗ™дЄїз†ФеПСзЪДеЕНзЦЂеМїе≠¶еє≥еП∞еПѓжП≠з§ЇеТМзњїиѓСйАВеЇФжАІеЕНзЦЂз≥їзїЯзЪДйБЧдЉ†еѓЖз†БпЉМеєґиГљеЇФзФ®дЇОзЩМзЧЗгАБиЗ™иЇЂеЕНзЦЂжАІзЦЊзЧЕгАБдЉ†жЯУжАІзЦЊзЧЕз≠ЙеЕНзЦЂдїЛеѓЉжАІзЦЊзЧЕзЪДиѓКжЦ≠гАБзЫСжµЛеТМж≤їзЦЧдЄ≠гАВ

