
研究人员通过常规使用的实时荧光定量PCR(qPCR)患者特异性检测和二代测序(NGS)方法对432例接受AIEOP-BFM ALL 2009方案治疗的B细胞前体急性淋巴细胞(ALL)白血病患儿的780种免疫球蛋白/T细胞受体(IG/TR)标志物评估了微小残留病(MRD)水平并进行了比较。研究人员的目的是比较诱导结束(EOI)时基于MRD的风险分层。639/780(81.9%)种标志物的结果是一致的,37/780(4.7%)种标志物仅NGS阳性。在104/780(13.3%)种仅qPCR阳性的标志物中,很大一部分(23/104;22.1%)也能通过NGS检测到。但由于在无关的样本中存在相同的IG/TR重排,研究人员将其视为非特异性/假阳性。在EOI时,根据qPCR和NGS的MRD结果进行风险组分层,76%的患者是一致的,19%的患者将被NGS归类到较低风险组,主要是消除了假阳性qPCR结果,5%的患者将被NGS归类到更高风险组。NGS MRD与qPCR高度一致,同时提供更具体的结果,并且可以在未来的基于MRD的方案中作为一线MRD评估的替代方案。
运用多参数流式细胞术(MFC),克隆免疫球蛋白(IG)和T细胞受体(TR)基因重排的定量代表了目前在儿童急性淋巴细胞白血病(ALL)患者治疗方案中检测微小残留病灶/可检出的残留病灶(MRD)的标准。随着二代测序(NGS)技术的不断发展,其在淋巴恶性肿瘤MRD检测中的应用越来越广泛,研究人员的研究小组和其他研究人员也发表了NGS MRD检测方法,证明了其在临床应用中的相关性。然而,一个尚未解决的主要问题是MRD定量的准确性以及与患者特异性定量PCR(qPCR)的相关性,目前大多数欧洲儿童和成人的所有治疗方案中都使用该方法进行风险分层。研究人员的目标是确定NGS是否可以在第33天(EOI)——对所有接受AIEOP-BFM ALL 2009方案治疗的B细胞前体(BCP)患儿进行风险分层的主要层时间点,如qPCR一样成功地用于基于MRD的风险分层。
在2010年至2018年间,共有458名在捷克共和国接受AIEOP-BFM ALL 2009方案治疗的患者被诊断为BCP ALL。研究人员排除了19名患者,这些患者要么无法达到qPCR检测所需的灵敏度10-4而在诊断时未鉴定出可用的IG/TR MRD标志物,要么无法获得第33天骨髓(BM)抽吸物的DNA(图1A)。该研究是根据赫尔辛基宣言进行的,并得到捷克共和国布拉格查尔斯大学第二医学院机构审查委员会的批准。
根据EuroMRD指南对IG/TR MRD标志物进行检测,理论上使用两种具有最佳灵敏度和质量范围(QR)的独立qPCR检测方法进行MRD评估。对从第33天采集的BM抽吸物中提取的DNA样本进行评估(图1B),低于QR的MRD阳性认为是阳性不可量化(PnQ)。NGS文库是根据EuroClonality-NGS工作组研究构建的。在总共709个NGS文库中,702(99%)个成功扩增和测序,只有7个因NGS文库构建错误而被排除(图1A)。
测序数据使用内部数据处理管道进行分析,并使用ARResT/Interrogate进行深度评估。根据EuroClonality-NGS的cIT-QC和每个文库的总DNA模板量,对NGS MRD结果进行标准化和量化。低于理论质量范围的NGS MRD水平被评估为PnQ。从原始Sanger测序数据中提取CDR3核苷酸序列,用于在NGS文库中识别患者特异性IG/TR MRD标志物(图1B)。任何NGS阳性都需要至少3条reads的对应序列。
研究人员对702个NGS文库进行了测序,中位数为1629389条reads,并用qPCR和NGS对432例患者的780种独特的IG/TR MRD标志物进行了检测。由于qPCR MRD检测的灵敏度和特异性受每种IG/TR标志物的特征及其V(D)J组合的复杂性的强烈影响,因此其用于MRD评估的可用性取决于基于多克隆非恶性肿瘤背景下的非特异性扩增的标准。为了确定所有筛选出的标志物NGS MRD检测的特异性,研究人员分析了它们的连接核苷酸序列,并且按照补充方法确定了它们的特异性,还鉴定出了54种不符合充分特异性标准的标志物。
研究人员通过两种方法获得了419种阴性标志物(53.7%)和220种阳性标志物(28.2%)的一致结果。另外,104种标志物(13.3%)仅为qPCR阳性,其中绝大多数(97;93.3%)是PnQ,并且发现这当中的55种标志物(52.9%)是用于qPCR评估的多克隆对照的非特异性扩增。更重要的是,虽然这104种标志物中的23种(22.1%)也能使用NGS方法检测到,但它们被归类为非特异性(如上所述),其特异性差进一步被多克隆对照的非特异性qPCR扩增所证明,尽管其中18种Ct值较高(根据EuroMRD指南不影响qPCR阳性)。同样,仅NGS阳性的37种标志物中的23种(62%)是PnQ,其余可量化的14种标志物的平均NGS-MRD值为3.62×10-5(图1C-D)。
基于第33天MRD结果的风险分层,qPCR和NGS的结果在76%的患者中是一致的,其中193例患者(44.7%)被归类到SR组,100例患者(23.1%)被归类到MR组,37例患者(8.6%)被归类到HR组(图2A)。根据NGS结果,19名患者(4.4%)被归类到更高风险组,82名患者(19%)被归类到更低风险组,这主要是由于消除了假阳性结果(图2A)。根据NGS结果,一名患者被归类到SR组,其只有一个TRG MRD标志物呈qPCR高度阳性,但在NGS数据中未检测到。然而,在NGS再筛查中发现的一个主要克隆TRG重排证实了该患者的HR分层(补充结果)。
研究人员还发现两种方法计算的MRD值的显著相关性(R2=0.83,图2B)。考虑到qPCR和NGS 之间MRD定量的差异,不能期望这两种方法具有完美的数值相关性。此外,NGS MRD 还提供比传统使用的qPCR检测更高的定量范围,因此信息量更大。
尽管在市售检测中经常强调MRD检测的高灵敏度,但任何MRD检测的真正灵敏度取决于评估细胞的数量,并且在MRD研究中,大量评估的样本未达到所期望的灵敏度(例如 Wood等人所著报告中的40%的样本)。重要的是保持高度的特异性并进行充分的检查以避免假阳性结果,不然会导致治疗强化,并可能导致严重的治疗相关毒性,尤其是在儿童患者中。研究人员分析了54种非特异性IG/TR标记的V(D)J 连接分割,其中大多数属于IGK,TRD和TRG基因座,并且它们连接处的N区显著缩短(补充结果),因此在患者特异性qPCR系统设计的选择过程中对它们的优先级提出了挑战。
由于其与qPCR检测相比具有更高的特异性,从而以高置信度消除了假阳性qPCR结果,NGS在基于MRD的临床方案中将具有不可检测MRD的患者的正确风险分层改进为标准风险组。然后这些患者可以考虑减少治疗。另一方面,即使是由NGS特异性检测到的非常低的MRD水平,也必须明确地将其视为真实值,并对患者进行相应强度的治疗。由EuroClonality-NGS工作组开发的一线NGS MRD评估可替代未来基于MRD的治疗方案中传统的基于qPCR的MRD定量。此外,这种方法可以立即用于方案外治疗监测和qPCR的PnQ结果的独立评估,通常在SCT之后。
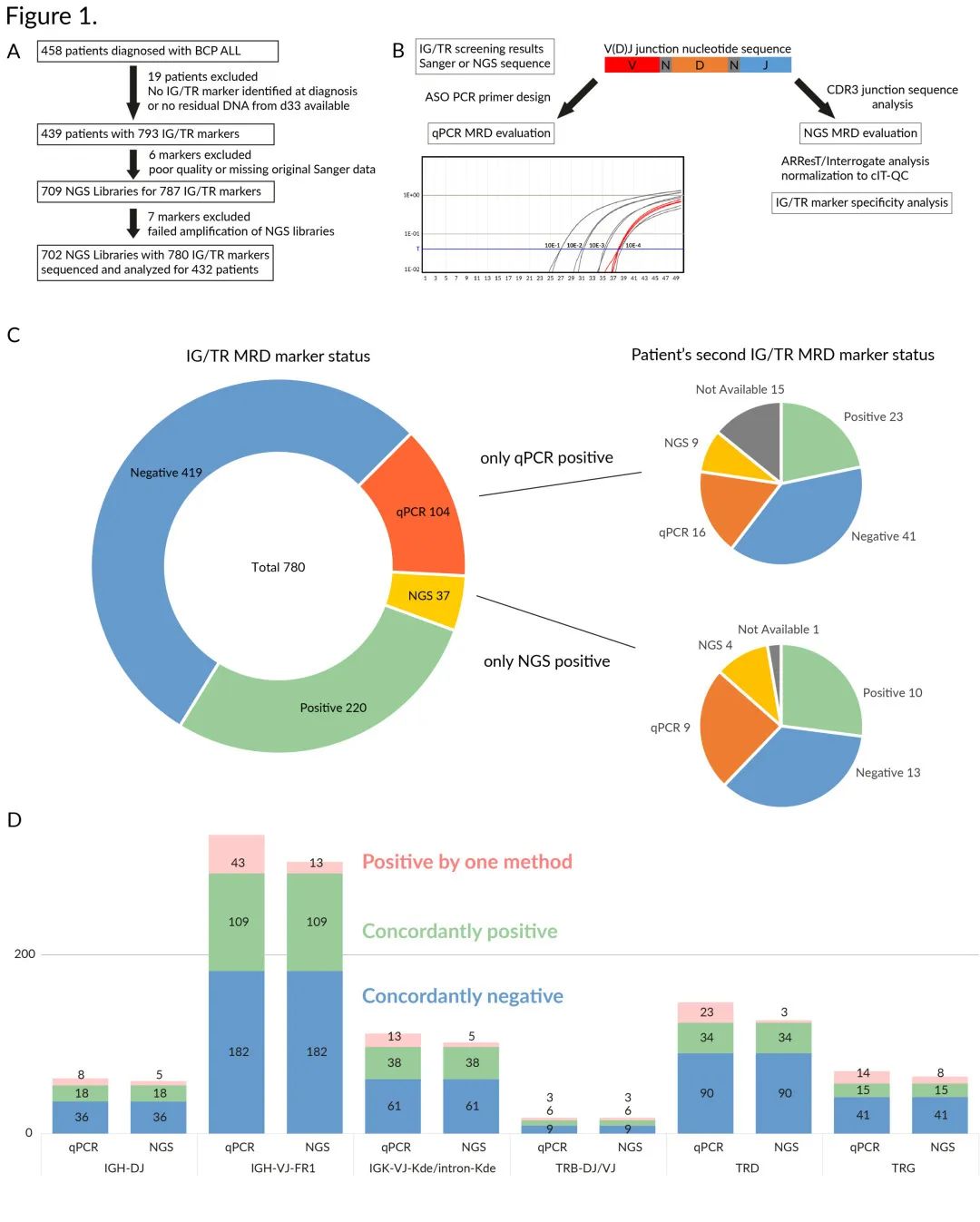
图1. 用qPCR和NGS对MRD标志物的研究和分类示意图。(A)显示排除标准以及研究中分析的患者和样本数量的研究流程图。(B)从诊断到第33天用qPCR和NGS进行MRD评估的IG/TR MRD标志物选择过程和分析图。(C)用qPCR和NGS检测的IG/TR MRD标志物分析结果。仅qPCR阳性(橙色)或仅NGS阳性(黄色)的标志物将根据对同一患者第二次MRD标志物的评估结果细分为子类别并标记为相同颜色,如果第二次检测MRD标志物不可用,则用灰色标记。(D)基于IG/TR重排的基因位点和使用的NGS文库制备引物混合物,对所有评估的MRD标志物及其结果进行分类。由于样本数量少,IGK-VJ-Kde和intron-Kde合并在一起,TRB-DJ和TRB-VJ重排也是如此。
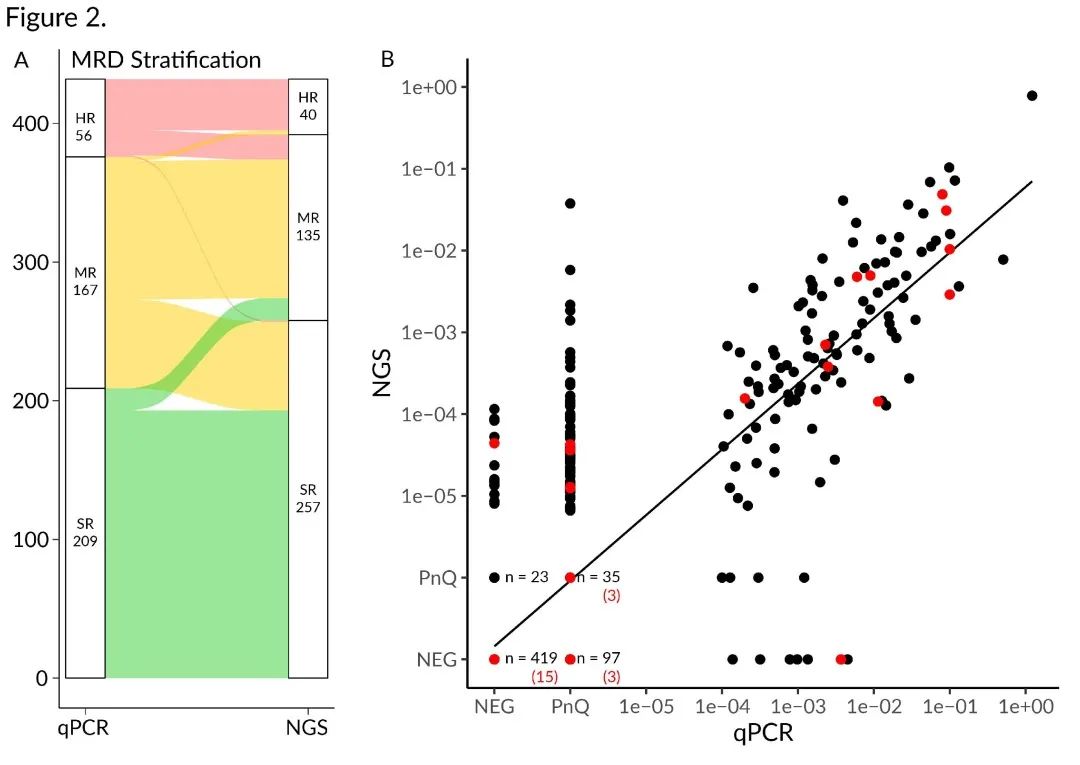
图2. 基于患者MRD的风险分层和MRD标志物的定量比较。(A)所有患者在第33天的qPCR或NGS MRD水平的风险分层冲积图。用于AIEOP-BFM ALL 2009方案中的HR MRD分层的MRD阈值为10-3。根据NGS MRD结果,16名患者(3.7%)从SR组转移到MR组,3名患者(0.7%)从MR组转移到HR组。相反,有64名患者(14.8%)从MR组转移到SR组,18名患者(4.2%)从HR组转移到MR组。(B)通过qPCR(X轴)或NGS(Y轴)检测的MRD水平的比较。复发患者的所有标志物均以红色标记。
参考文献:
Svaton M, Skotnicova A, Reznickova L, Rennerova A, Valova T, Kotrova M, van der Velden VHJ, Brüggemann M, Darzentas N, Langerak AW, Zuna J, Stary J, Trka J, Fronkova E. NGS better discriminates true MRD positivity for the risk stratification of childhood ALL treated on MRD-based protocol. Blood. 2022 Oct 14:blood.2022017003. doi: 10.1182/blood.2022017003. Epub ahead of print. PMID: 36240445.
点击下方原文链接可查看Seq-MRD®介绍
杭州艾沐蒽生物科技有限公司由美国芝加哥大学科研团队回国创办,是一家专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展的国家高新技术企业。艾沐蒽站在适应性免疫系统研究的前沿,自主研发的免疫医学平台可揭示和翻译适应性免疫系统的遗传密码,并能应用于癌症、自身免疫性疾病、传染性疾病等免疫介导性疾病的诊断、监测和治疗中。
原文始发于微信公众号(艾沐蒽生物科技):【Blood】2022最新研究:Ig/TCR NGS检测技术结果对ALL患儿诱导治疗后的危险度分层

