2017年8月30日:FDA宣布批准全球第一个CAR-T产品,诺华的CAR-T细胞药物Kymriah上市,用于治疗难治复发性B细胞前体急性淋巴性白血病,公布定价为每次治疗 475,000 美元。
2017年10月18日:FDA已经宣布批准了Kite的CAR-T细胞药物Yescarta上市,用于治疗罹患特定类型的大B细胞淋巴瘤成人患者,每次治疗费用373,000美元。

2017年注定成为CAR-T领域不平凡的一年。随着国际上两款CAR-T 疗法获批上市,以及我国相关法律法规的建立健全,细胞治疗技术也将在我国迎来大发展,未来几年高质量的国产CAR-T 产品有望上市。根据美国ClinicalTrials.gov网站统计的数据,目前中国开展的、与CAR-T相关的临床试验项目有上百个,与美国同列为全球CAR-T研究的第一梯队。中国作为癌症高发大国,每年大约有400万左右的新增病例,临床治疗对CAR-T技术的需求十分迫切,有着庞大的市场需求。我国大力支持包括CAR-T技术在内的高端医疗技术的开发和应用。
免疫疗法正剧烈改变着血液癌症治疗的方式,随着CAR-T治疗的上市和面临大规模临床试验的挑战。这种情形下,如何甄别精准获益于CAR-T疗法的人群,以及在治疗过程中找到合适的临床标志物实时预测其有效性,这就显得尤为重要。艾沐蒽生物开发的Immu-HubTM技术平台能实现通过监测T细胞以及分析患者个体的整体免疫功能特征,来判断CART治疗效果,从而更好地分析患者对于癌症免疫疗法的治疗反应,提早预测包括细胞免疫疗法在内的抗癌免疫疗效。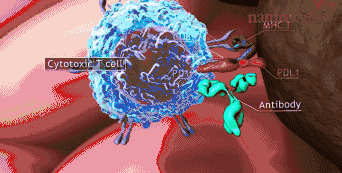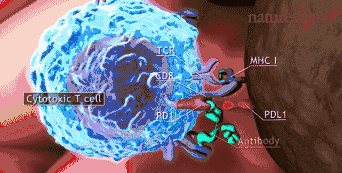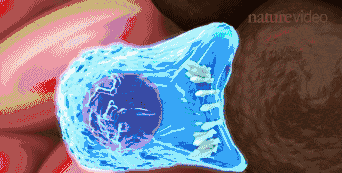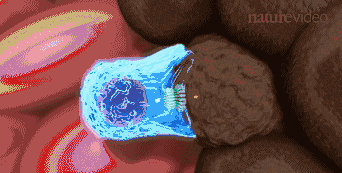
近日,艾沐蒽生物与浙江大学医学院附属第一医院黄河教授团队合作的相关部分研究结果亮相于在福州举行的第十六届全国实验血液学学术会议。研究结果表明,有效的CAR-T细胞疗法对T细胞受体库的克隆性和多样性有巨大影响,治疗后会出现明显的T细胞克隆性增殖,而无效的CAR-T治疗并未产生T细胞克隆性增殖。这提示CAR-T对肿瘤的杀伤会使得更多的癌细胞抗原释放,可以促进肿瘤抗原特异性T细胞的克隆性增殖。这些克隆性扩增的T细胞也许可以和CAR-T细胞一道杀伤肿瘤细胞,放大CAR-T细胞的治疗效应。

艾沐蒽生物将继续优化研发TCR测序技术在血液癌免疫治疗的临床试验上的应用研究,为CAR-T治疗提供可预测的生物标记物,以帮助评估预测患者的临床治疗反应。
第十六届全国实验血液学学术会议于2017年10月20日-22日在福州市召开。会议由中国病理生理学会实验血液学专委会主办,福建医科大学附属协和医院、福建省血液病研究所联合承办。会议主题包括血液肿瘤生物学和靶向治疗、干细胞和造血调控、血栓和血管生物学、血液免疫学等。本次大会采用特邀报告、大会发言和分会讨论的形式,邀请国内外血液学领域著名专家学者就目前血液学研究的热点问题进行广泛交流。
杭州艾沐蒽生物科技有限公司是由杭州市江干区政府、浙江大学投资基金投资引进,由美国芝加哥大学、耶鲁大学、康奈尔大学、哈佛大学的医学科研团队回国创办,是我国目前唯一一家,与国际同步的专注于免疫系统基因检测的企业。拥有自主知识产权ImmuHubTM技术平台。基于发明专利技术研发的多种临床产品和服务,在肿瘤精准医学诊断中具有重要应用。艾沐蒽生物作为免疫基因组测序领域中的领头羊,依靠自身强大的高通量测序技术和高效的临床转化能力,将最新的国际领先技术转化为服务于中国的临床和科研产品。
如需了解更多有关TCR高通量测序相关信息,欢迎联系艾沐蒽生物。
咨询电话:0571-88981304;
官网:www.immuquad.com;
地址:杭州市浙江大学(紫金港校区)纳米研究院大楼
