
йҐШзЫЃпЉЪеЬ®жЦ∞иЊЕеК©ж≤їзЦЧзЪДNeoALTTOеТМCALGB 40601йЪПжЬЇиѓХй™МдЄ≠пЉМеЕНзЦЂе≠¶еТМдЄіеЇКзЧЕзРЖе≠¶зЙєеЊБеПѓдї•йҐДжµЛher2йШ≥жАІдє≥иЕЇзЩМзЪДйҐДеРО еПСи°®жЬЯеИКпЉЪNature Communications еПСи°®жЧґйЧіпЉЪ2023еєі11жЬИ ељ±еУНеЫ†е≠РпЉЪ16.6 ¬† ¬† еЬ®жО•еПЧжЦ∞иЊЕеК©ж≤їзЦЧзЪДжВ£иАЕдЄ≠иѓЖеИЂйҐДеРОж†ЗењЧзЙ©еѓєдЇОHER2йШ≥жАІдє≥иЕЇзЩМзЪДж≤їзЦЧдЉШеМЦиЗ≥еЕ≥йЗНи¶БпЉМиАМеЕНзЦЂеЊЃзОѓеҐГжШѓдЄАдЄ™еЕ≥йФЃеЫ†зі†гАВеЬ®иѓ•еЫЮй°ЊжАІз†Фз©ґдЄ≠пЉМдљЬиАЕйАЪињЗеѓєBCRеТМTCRеЇУзЪДи°®еЊБињЫдЄАж≠•еЙЦжЮРдЇЖHER 2йШ≥жАІдє≥иЕЇзЩМзЪДеЉВиі®жАІпЉМжΥ糥дЇЖBCRгАБTCRеЇУе§Ъж†ЈжАІеѓєж≤їзЦЧеПНеЇФеТМйҐДеРОзЪДељ±еУНгАВеП¶е§ЦдљЬиАЕжХіеРИдЇЖеЕНзЦЂе≠¶еТМдЄіеЇКзЧЕзРЖе≠¶зЙєеЊБдї•еПКж≤їзЦЧеПНеЇФпЉМеїЇзЂЛдЄАдЄ™йҐДеРОж®°еЮЛпЉМеПѓдї•еЃЮзО∞еЗЖз°ЃзЪДйҐДеРОеИЖе±ВпЉМдЄЇеЃЮжЦљдЉШеМЦзЪДжЦ∞иЊЕеК©/жЬѓеРОж≤їзЦЧз≠ЦзХ•еЉАиЊЯйБУиЈѓгАВ ¬† ¬† дїОNeoALTTOеТМCALGB 40601дЄ§дЄ™дЄіеЇКиѓХй™МзЪДRNA-seqжХ∞жНЃдЄ≠йЙіеЃЪBCRеТМTCRеЕЛйЪЖеЮЛгАВйАЪињЗе§Ъж†ЈжАІжМЗжХ∞пЉИGiniжМЗжХ∞пЉМGini-SimpsonжМЗжХ∞еТМеЭЗеМАеЇ¶evennessжМЗжХ∞пЉЙгАБtop1еЕЛйЪЖгАБsecondеЕЛйЪЖзЪДеН†жѓФгАБCDR3ж†ЄиЛЈйЕЄйХњеЇ¶з≠ЙжМЗж†ЗжЭ•жППињ∞BCR/TCRеЇУзЪДзЙєеЊБгАВ ¬† ¬† дљЬиАЕжΥ糥дЇЖBCRеТМTCRеЇУзЙєеЊБдЄОжњАзі†еПЧдљУзКґжАБгАБPAM 50дЇЪеЮЛгАБTILж∞іеє≥зЪДеЕ≥иБФгАВ ¬† ¬† е¶ВеЫЊ1aжЙАз§ЇпЉМдЄОHR+иВњзШ§зЫЄжѓФпЉМHR-иВњзШ§еЕЈжЬЙжШЊиСЧжЫійЂШзЪДBCRиѓїжХ∞еТМеЕЛйЪЖжХ∞пЉМи°®жШОжЫійЂШж∞іеє≥зЪДBзїЖиГЮ浪洶дЄОHR-иВњзШ§зЪДжЫійЂШеЕНзЦЂеОЯжАІзЫЄдЄАиЗігАВ ¬† ¬† еЬ®PAM 50дЇЪеЮЛдєЛйЧіпЉМBCRеЇУжЫіеЕЈжЬЙеЉВиі®жАІпЉМе§Ъж†ЈжАІжМЗжХ∞гАБTOP1еТМsecondеЕЛйЪЖзЪДжѓФдЊЛеИЖеЄГз≠ЙеЭЗдЄНеРМпЉИеЫЊ1bпЉЙпЉМиАМTCRеЇУжЫіеЭЗеМАдЇЫгАВжАїдљУиАМи®АпЉМдЄОLumAгАБnormal-likeж†ЈжЬђзЫЄжѓФпЉМHER2-EгАБbasal-likeеТМLumBж†ЈжЬђжШЊз§ЇеЗЇдЄОBзїЖиГЮдїЛеѓЉзЪДеЕНзЦЂеЇФз≠ФеТМеЕЛйЪЖжЙ©еҐЮжњАжіїзЫЄдЄАиЗізЪДзЙєеЊБгАВ ¬† ¬† TILж∞іеє≥дї•иВњзШ§еЖЕеЯЇиі®йЭҐзІѓзЪД%иѓДеИЖеЃЪдєЙгАВBCRеТМTCRзЪДж†ЗеЗЖеМЦиѓїжХ∞гАБеЕЛйЪЖжХ∞гАБдї•еПКBCRеЯЇе∞ЉжМЗжХ∞дЄОTILж∞іеє≥еСИдЄ≠з≠Йж≠£зЫЄеЕ≥пЉМBCRеЭЗеМАеЇ¶гАБTCR TOP1еТМsecondеЕЛйЪЖйҐСзОЗдЄОTILж∞іеє≥еСИиіЯзЫЄеЕ≥гАВзФ±дЇОTILж∞іеє≥еТМBCR/TCRе§Ъж†ЈжАІжµЛйЗПдєЛйЧізЪДзЫЄеЕ≥жАІжШѓдЄ≠з≠ЙзЪДпЉМеЫ†ж≠§зФ±TILеЃЪйЗПеТМBCR/TCRи°®еЊБеЄ¶жЭ•зЪДдњ°жБѓеПѓдї•жШѓдЇТи°•зЪДгАВдЄОTILеЃЪйЗПзЫЄжѓФпЉМе§Ъж†ЈжАІжµЛйЗПеПѓиГљжПРдЊЫеЕНзЦЂеЇФз≠ФжЦєйЭҐзЪДвАЬеЃЪжАІвАЭдњ°жБѓгАВ
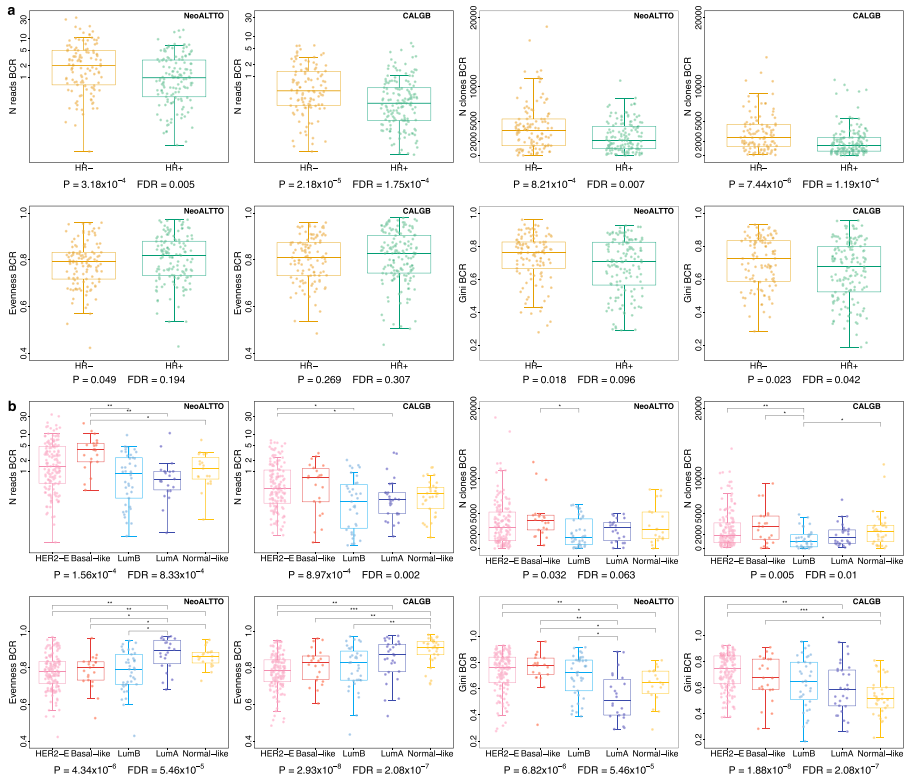
еЫЊ1 ¬† ¬† дљЬиАЕеЬ®NeoALTTOеТМCALGB 40601йШЯеИЧдЄ≠ињЫи°МдЇЖеНХеПШйЗПеТМе§ЪеПШйЗПеИЖжЮРпЉМиѓБжШОдЇЖBCR/TCRзЪДжљЬеЬ®йҐДеРОдљЬзФ®гАВељУжОІеИґдЄіеЇКзЧЕзРЖе≠¶зЙєеЊБжЧґпЉМиЊГйЂШзЪДTCRеЭЗеМАеЇ¶еТМиЊГдљОзЪДеЯЇе∞ЉжМЗжХ∞пЉМTOP1еТМsecondеЕЛйЪЖйҐСзОЗдЄОNeoALTTOдЄ≠иЊГйЂШзЪДpCRпЉИpathological complete responseпЉЙзОЗзЫЄеЕ≥пЉМиАМиЊГйЂШзЪДBCRиѓїжХ∞гАБеЕЛйЪЖжХ∞еТМеЯЇе∞ЉжМЗжХ∞дЄОCALGB 40601дЄ≠зЪДpCRж≠£зЫЄеЕ≥гАВ ¬† ¬† еЬ®еНХеПШйЗПеИЖжЮРдЄ≠пЉМи∞ГжХіе§ЪйЗНж£Ай™МзЪДPеАЉеРОпЉМBCR/TCRзЙєеЊБдЄОEFSжЧ†жШЊиСЧзЫЄеЕ≥жАІпЉИеЫЊ2aпЉМbпЉЙгАВељУж†°ж≠£дЄіеЇКзЧЕзРЖе≠¶зЙєеЊБжЧґпЉМBCRеЭЗеМАеЇ¶еТМGiniжМЗжХ∞дЄОNeoALTTOдЄ≠зЪДEFSжШЊиСЧзЫЄеЕ≥пЉИеЫЊ2cпЉЙпЉМBCRиѓїжХ∞гАБеЕЛйЪЖжХ∞гАБеЭЗеМАеЇ¶еТМеЯЇе∞ЉжМЗжХ∞дЄОCALGB 40601дЄ≠зЪДEFSзЫЄеЕ≥пЉИеЫЊ2dпЉЙгАВињЩдЇЫзїУжЮЬи°®жШОBзїЖиГЮеЕЛйЪЖжАІжЙ©еҐЮеЕЈжЬЙзІѓжЮБзЪДйҐДеРОдљЬзФ®пЉМи°®зО∞дЄЇиЊГдљОзЪДBCRеЭЗеМАеЇ¶еТМиЊГйЂШзЪДGiniжМЗжХ∞гАВ
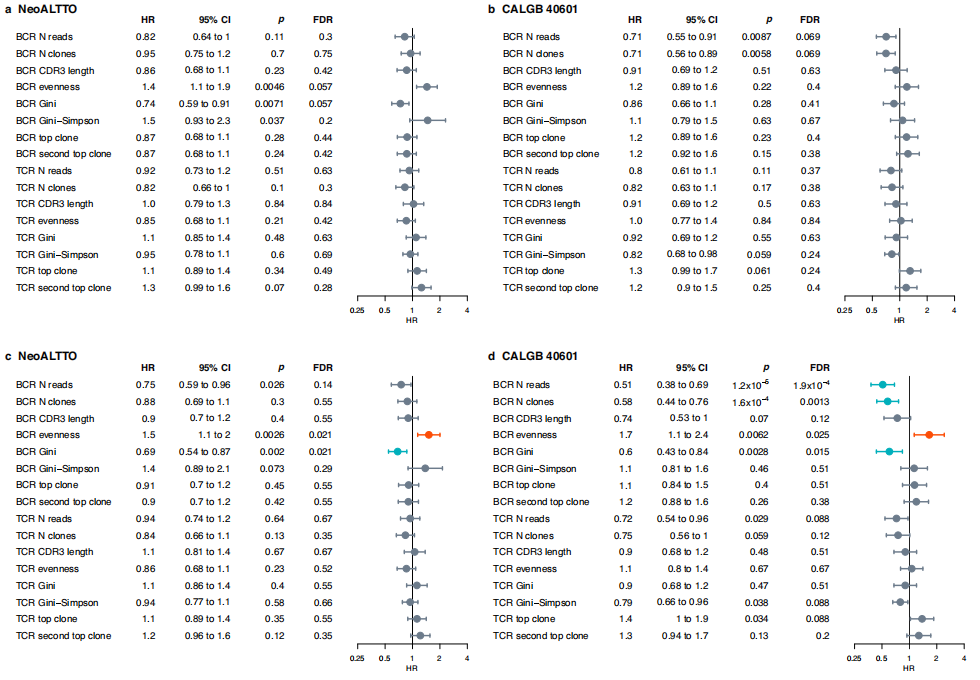
еЫЊ2 ¬† ¬† жО•дЄЛжЭ•дљЬиАЕжµЛиѓХдЇЖеМЕеРЂеЯЇзЇњдЄіеЇКзЧЕзРЖзЙєеЊБгАБеЕНзЦЂзЫЄеЕ≥зЙєеЊБеТМж≤їзЦЧзЫЄеЕ≥дњ°жБѓзЪДж®°еЮЛжШѓеР¶еПѓдї•йҐДжµЛEFSгАВеМЕжЛђжњАзі†еПЧдљУзКґжАБгАБpCRгАБBCRеЭЗеМАжАІгАБжЈЛеЈізїУзКґжАБеТМTILзЪДиѓДеИЖпЉИеСљеРНдЄЇHER2-EveNTпЉЙдЄАиµЈзЇ≥еЕ•еПШйЗПйАЙжЛ©ињЗз®ЛпЉМNeoALTTOиѓХй™МзЪД221дЊЛжВ£иАЕдљЬдЄЇиЃ≠зїГйЫЖгАВиЃ°зЃЧиЃ≠зїГйШЯеИЧзЪДCжМЗжХ∞иѓДеИЖпЉМе∞ЖиѓДеИЖеИЖдЄЇдЄЙеИЖдљНжХ∞пЉМеєґињЫи°МKaplan-MeierеИЖжЮРдї•дЉ∞зЃЧEFSгАВж†єжНЃ5еєіEFSеИЖжИРдЄ§дЄ™зїДпЉМеИЖеИЂжШѓйҐДеРОиЙѓе•љзїДпЉИN = 78пЉМEFSзОЗ92%пЉЙеТМйҐДеРОдЄНиЙѓзїДпЉИN = 155пЉМEFSзОЗ65%пЉЙпЉИеЫЊ3aпЉЙгАВ ¬† ¬† ж†єжНЃињЩдЄ™ж®°еЮЛеПѓдї•йЙіеЃЪеЕЈжЬЙдЄНеРМйҐДеРОзЪДжВ£иАЕдЇЪзїДпЉМиАМдЄНиЃЇpCRзКґжАБе¶ВдљХпЉИеЫЊ3b-cпЉЙпЉМињЩжШѓзФ±дЇОдЇЪзїДдЄ≠еЕґдїЦеПШйЗПзЪДељ±еУНгАВдє≥иЕЇpCRжВ£иАЕеЬ®дЄ§дЄ™йҐДеРОзїДдЄ≠зЪД5еєіEFSзОЗеИЖеИЂдЄЇ97%еТМ72%пЉМжЬ™иЊЊеИ∞pCRзЪДжВ£иАЕеЬ®дЄ§дЄ™йҐДеРОзїДдЄ≠зЪД5еєіEFSзОЗеИЖеИЂдЄЇ85%еТМ62%гАВ
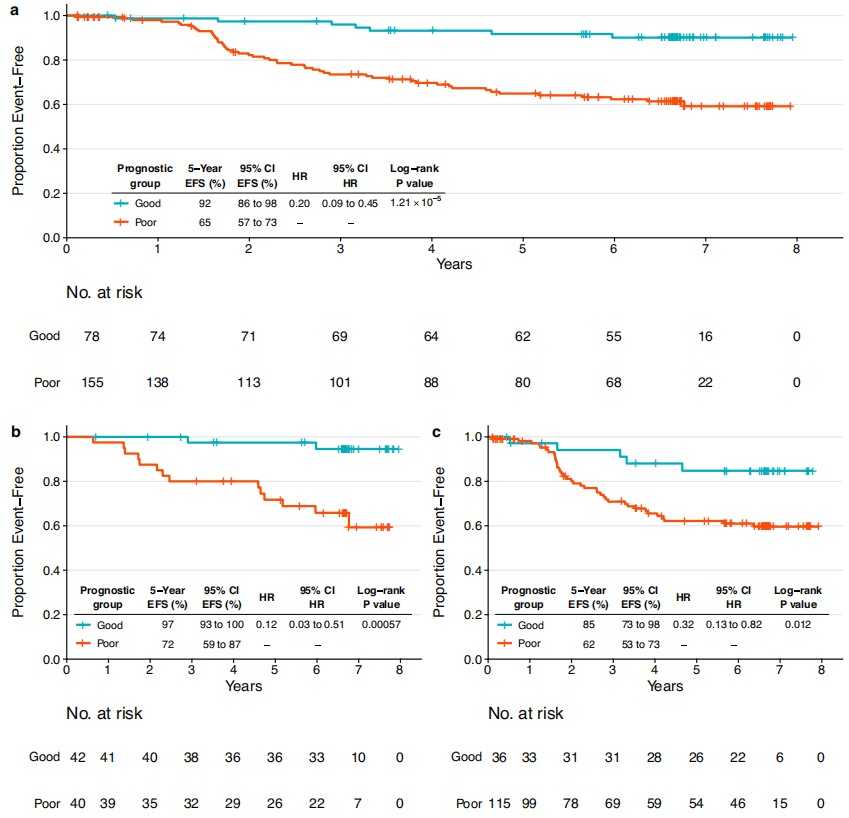
еЫЊ3 ¬† ¬† зДґеРОеЬ®CALGB 40601зїДдЄ≠еѓєж®°еЮЛињЫи°Мй™МиѓБгАВйҐДеРОиЙѓе•љзїДеТМйҐДеРОдЄНиЙѓзїДзЪД5еєіEFSзОЗеИЖеИЂдЄЇ93%еТМ75%пЉИеЫЊ4aпЉЙгАВpCRзїДзЪДеЈЃеЉВжЧ†жШЊиСЧзїЯиЃ°е≠¶жДПдєЙпЉМдљЖиІВеѓЯеИ∞дЄОиЃ≠зїГйЫЖзЫЄдЉЉзЪДиґЛеКњпЉИеЫЊ4bпЉЙгАВеЬ®жЬ™еЃЮзО∞дє≥иЕЇpCRзЪДжВ£иАЕдЄ≠йЙіеЃЪеЗЇеЕЈжЬЙдЄНеРМйҐДеРОзЪДзїДпЉИеЫЊ4cпЉЙпЉМињЩдЄОиЃ≠зїГйЫЖдЄ≠зЪДеПСзО∞дЄАиЗігАВ ¬† ¬† ељУжѓФиЊГйҐДеРОиЙѓе•љзїДpCRжВ£иАЕеТМжЬ™pCRжВ£иАЕзЪДEFSжЧґпЉМеЬ®иЃ≠зїГйЫЖеТМй™МиѓБйЫЖдЄ≠еЭЗжЬ™еПСзО∞жШЊиСЧеЈЃеЉВпЉМTILгАБBCRеЭЗеМАжАІгАБжЈЛеЈізїУзКґжАБеТМйЫМжњАзі†еПЧдљУзКґжАБз≠Йз±їдЉЉзЪДеПШйЗПдєЯжШѓе¶Вж≠§гАВжАїдєЛпЉМзїЉеРИдЄіеЇКзЧЕзРЖзЙєеЊБгАБж≤їзЦЧеПНеЇФдњ°жБѓеТМеЕНзЦЂе≠¶зЙєеЊБзЪДе§Ъж®°еЉПжЦєж≥ХеѓєдЇОйҐДжµЛжВ£иАЕзЪДйҐДеРОйЭЮеЄЄйЗНи¶БгАВ
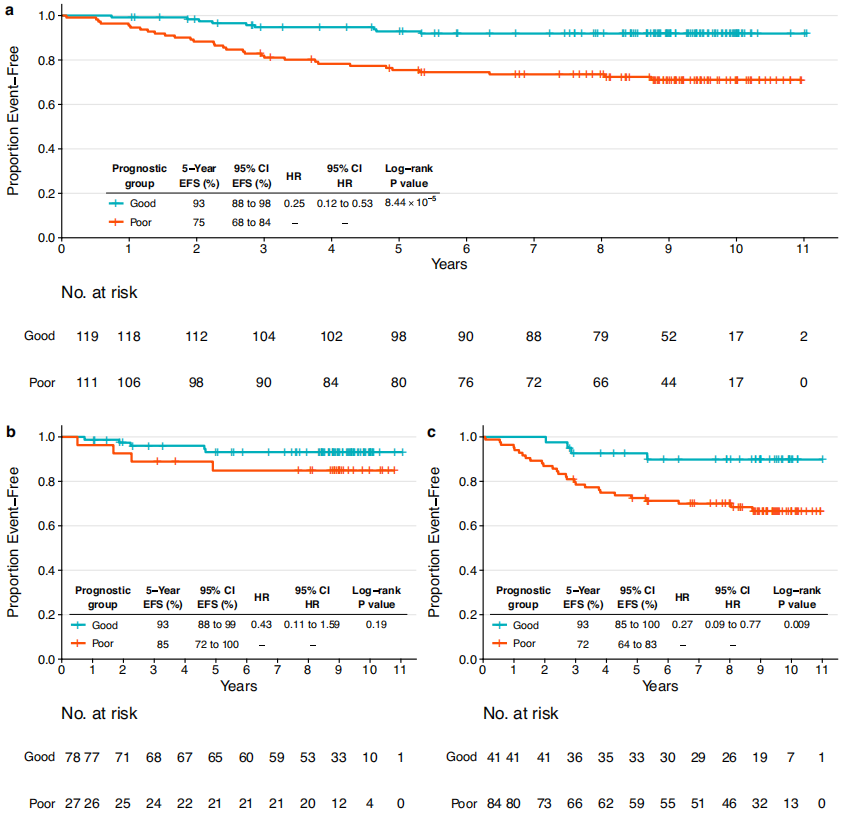
еЫЊ4 ¬† ¬† зДґеРОдљЬиАЕиѓДдЉ∞дЇЖдЄ§й°єз†Фз©ґдЄ≠дљЬдЄЇињЮзї≠еПШйЗПзЪДHER2-EveNTиѓДеИЖдЄОзФ®еЯЇеЫ†зїДеПШеЉВеИЖжЮРпЉИGSVAпЉЙеЈ•еЕЈиЃ°зЃЧзЪДж†ЗењЧжАІзФЯзЙ©ињЗз®ЛиѓДеИЖдєЛйЧізЪДзЫЄеЕ≥жАІпЉИеЫЊ5пЉЙгАВеЕНзЦЂзЫЄеЕ≥йАЪиЈѓгАБPI3K/AKT/mTORдњ°еПЈдЉ†еѓЉеТМеҐЮжЃЦпЉИдЊЛе¶ВпЉМMYCйЭґзВєгАБE2FйЭґзВєпЉЙжШЊз§ЇдЄОHER2-EveNTиѓДеИЖзЪДиіЯзЫЄеЕ≥жАІжЬАйЂШгАВињЩдЇЫзїУжЮЬжљЬеЬ®еЬ∞жППињ∞дЇЖеҐЮжЃЦеТМHER2дЄЛжЄЄдњ°еПЈдЉ†еѓЉдЄОpCRзЪДеЕ≥иБФгАВж≠§е§ЦпЉМNotchеТМTGFќ≤дњ°еПЈдЉ†еѓЉдї•еПКиВМзФЯжИРгАБEMTеТМи°АзЃ°зФЯжИРињЩдЇЫ襀聧䪯дЄОеЕНзЦЂйАГйБњжЬЇеИґеТМиВњзШ§ињЫе±ХжЬЙеЕ≥зЪДеЫ†зі†пЉМдЄОй£ОйЩ©иѓДеИЖеСИж≠£зЫЄеЕ≥пЉМеЫ†ж≠§йҐДеРОиЊГеЈЃгАВ
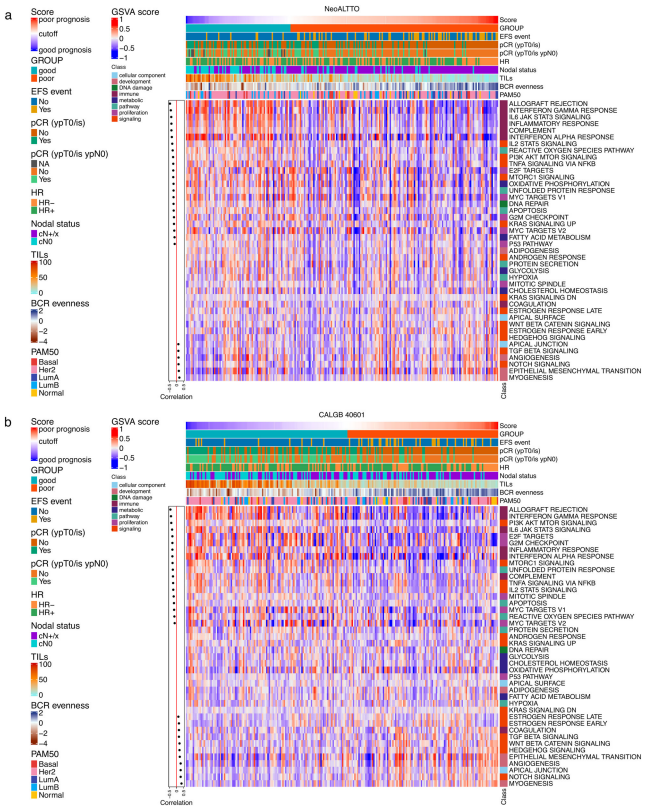
еЫЊ5 ¬† ¬† йҐДеРОиЙѓе•љзЪДpCRеТМжЃЛзХЩзЧЕпЉИRDпЉЙзїДеЭЗеСИзО∞жШОжШЊзЪДеЕНзЦЂзЙєеЊБеѓМйЫЖгАВйҐДеРОдЄНиЙѓзЪДж†ЈжЬђпЉМзЙєеИЂжШѓйВ£дЇЫжВ£жЬЙRDзЪДж†ЈжЬђпЉМеПНиАМеСИзО∞еЗЇиЊГдљОзЪДеЕНзЦЂзЫЄеЕ≥дњ°еПЈгАВж≠§е§ЦпЉМжЧ†иЃЇйҐДеРОе¶ВдљХпЉМиЊЊеИ∞pCRзЪДиВњзШ§жШЊз§ЇеЗЇжЫійЂШзЪДERBB2еТМжЫідљОзЪДESR1и°®иЊЊж∞іеє≥пЉМеєґдЄФPIK3CAйАЪиЈѓжњАжіїзЙєеЊБеЬ®еЕЈжЬЙpCRеТМиЙѓе•љйҐДеРОзЪДиВњзШ§дЄ≠жЫійЂШгАВ ¬† ¬† ињЩдЇЫеПСзО∞и°®жШОпЉМж†єжНЃж®°еЮЛпЉМеЬ®е±ЮдЇОеРМдЄАйҐДеРОзїДзЪДиВњзШ§дЄ≠пЉМиВњзШ§зЪДеЖЕеЬ®зФЯзЙ©е≠¶зЙєжАІдЉЉдєОжШѓжЦ∞иЊЕеК©ж≤їзЦЧеПНеЇФзЪДдЄїи¶Бй©±еК®еЫ†зі†пЉМињЩеПѓдї•зФ®pCRжЭ•и°°йЗПгАВзЫЄжѓФдєЛдЄЛпЉМеЕНзЦЂзЫЄеЕ≥зЙєеЊБдЄїи¶БдЄОйҐДеРОзЫЄеЕ≥пЉМдЄОpCRзКґжАБжЧ†еЕ≥гАВ ¬† ¬† иѓ•з†Фз©ґиѓБжШОдЇЖHER2йШ≥жАІдє≥иЕЇзЩМдЄ≠BCRеЇУжµЛйЗПеТМеЕНзЦЂеПНеЇФзЪДеЉВиі®жАІпЉМдї•еПКBCRе§Ъж†ЈжАІдљЬдЄЇйҐДеРОзФЯзЙ©ж†ЗењЧзЙ©зЪДжљЬеКЫгАВжЮДеїЇзЪДйҐДеРОж®°еЮЛйЙіеИЂеЗЇдЇЖдЄАзїДеЕЈжЬЙеЕНзЦЂзЙєеЊБеѓМйЫЖзЪДиВњзШ§жВ£иАЕпЉМињЩдЇЫжВ£иАЕеН≥дљње≠ШеЬ®жЃЛзХЩзЧЕдєЯеПѓиГљзђ¶еРИйЩНзЇІж≤їзЦЧзЪДжЭ°дїґгАВеєґеЉЇи∞ГдЇЖжХіеРИдЄіеЇКзЧЕзРЖзЙєеЊБгАБж≤їзЦЧеПНеЇФдњ°жБѓеТМеЕНзЦЂзЫЄеЕ≥зЙєеЊБдї•з°ЃеЃЪжЦ∞иЊЕеК©ж≤їзЦЧдЄіеЇКй£ОйЩ©зЪДйЗНи¶БжАІгАВ жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖжХ∞еНБзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪNature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ
