TжЈЛеЈізїЖиГЮйАЪињЗеЕґи°®йЭҐзЪДеПЧдљУTCRжЭ•иѓЖеИЂжКЧеОЯпЉМдЄЇдЇЖиГље§ЯиѓЖеИЂжХ∞зЩЊдЄЗзІНзЪДзЦЊзЧЕжКЧеОЯпЉМTCRеЇУйЬАдњЭжМБеЊИйЂШзЪДе§Ъж†ЈжАІпЉМеЫ†ж≠§TCRеЇУзЪДе§Ъж†ЈжАІжШѓйАВеЇФжАІеЕНзЦЂз≥їзїЯеПСжМ•дњЭжК§еКЯиГљзЪДеЕ≥йФЃеЫ†зі†пЉМеПѓдї•еПНжШ†еЕНзЦЂз≥їзїЯеБ•еЇЈзКґеЖµгАВеѓєе§ЦеС®и°АзїЖиГЮзЪДTCRйЗНйУЊпЉИTRBпЉЙеЯЇеЫ†ињЫи°МжЈ±еЇ¶жµЛеЇПеПѓдї•зЫСжµЛе§ЦеС®TзїЖиГЮеЇУеК®жАБеПШеМЦгАВ
зФЯзРЖи°∞иАБзЪДеРМжЧґдєЯдЉійЪПзЭАеЕНзЦЂи°∞иАБпЉМеЫ†ж≠§еБ•еЇЈдЇЇзЪДTCRеЇУжШѓйЪПеєійЊДеК®жАБеПШеМЦзЪДпЉМеєґдЄФињЩзІНеПШеМЦеЬ®зФЈжАІеТМе•≥жАІдЄ≠жЬЙжЙАдЄНеРМгАВдЄНдєЕеЙНеПСи°®дЇОFrontiers in ImmunologyдЄКзЪДдЄАдЄ™з†Фз©ґйАЪињЗеѓєдЄНеРМеєійЊДжЃµдЇЇзЊ§ињЫи°МTRBдЇМдї£жµЛеЇПпЉИNGSпЉЙпЉМйШРжШОзФЈжАІеТМе•≥жАІзЪДTRBеЇУйЪПеєійЊДеҐЮйХњеСИзО∞дЄНеРМзЪДеПШеМЦиґЛеКњгАВ

ж†ЗйҐШпЉЪдЇЇз±їе§ЦеС®TзїЖиГЮдЄОжАІеИЂеТМеєійЊДзЫЄеЕ≥зЪДеК®жАБеПШеМЦ
еПСи°®жЧґйЧіпЉЪ2023еєі10жЬИ
еПСи°®жЬЯеИКпЉЪFrontiers in Immunology
ељ±еУНеЫ†е≠РпЉЪ8.787
з†Фз©ґжЦєж≥ХпЉЪйЗЗйЫЖ2дЄ™жХ∞жНЃйЫЖпЉЪжЭ•иЗ™587еРН1-74е≤БеПЧж£АиАЕзЪДTRB NGSжХ∞жНЃйЫЖпЉИйГ®еИЖж†ЈжЬђеЫ†дњ°жБѓзЉЇе§±иҐЂеЙФйЩ§пЉЙпЉИж®™еРСжХ∞жНЃйЫЖпЉЙпЉЫжЭ•иЗ™6еРНењЧжДњиАЕзЪДзЇµеРСжХ∞жНЃйЫЖпЉМжѓПйЪФ10еєіеПЦж†ЈдЄАжђ°пЉМжѓПдЄ™дЇЇеПЦж†Ј3жђ°пЉМеИЖйАЙCD4+TзїЖиГЮеТМCD8+TзїЖиГЮињЫи°МTRBж£АжµЛгАВ
дљњзФ®Pielou’s JжМЗжХ∞иѓДдЉ∞TRBеЇУзЪДзКґжАБе§Ъж†ЈжАІпЉИStatus DiversityпЉЙеТМеЇПеИЧе§Ъж†ЈжАІпЉИSequence DiversityпЉЙгАВзКґжАБе§Ъж†ЈжАІжШѓйЗНжОТзЪДTRBеЯЇеЫ†еЇПеИЧеКЯиГљзКґжАБпЉИзФЯдЇІжАІйЗНжОТдЄОйЭЮзФЯдЇІжАІйЗНжОТпЉЙзЪДе§Ъж†ЈжАІпЉЫеЇПеИЧе§Ъж†ЈжАІжШѓжМЗзЛђзЙєTRBеЇПеИЧзЪДе§Ъж†ЈжАІгАВ
еЬ®487дЄ™ж†ЈжЬђзЪДж®™еРСжХ∞жНЃйЫЖдЄ≠пЉМзКґжАБе§Ъж†ЈжАІйЪПеєійЊДеҐЮйХњиАМзХ•еЊЃдљЖжШЊиСЧжАІдЄЛйЩНпЉИеЫЊ1AпЉЙгАВељУеИЖеИЂжЮДеїЇзФЈжАІеТМе•≥жАІзЪДеК†жЭГзЇњжАІеЫЮељТж®°еЮЛжЧґпЉМеП™жЬЙе•≥жАІж®°еЮЛзЪДзКґжАБе§Ъж†ЈжАІйЪПеєійЊДзЪДеҐЮйХњиАМжШЊиСЧдЄЛйЩНпЉИеЫЊ1CпЉЙпЉМж≤°жЬЙиІВеѓЯеИ∞еєійЊДеѓєзФЈжАІж®°еЮЛжЬЙжШЊиСЧељ±еУНпЉИеЫЊ1BпЉЙгАВ
зДґеРОеѓєзКґжАБе§Ъж†ЈжАІињЫи°МдЇЖеИЖжЃµеЫЮељТеИЖжЮРпЉМеПСзО∞дї•18-19е≤БдЄЇеИЖзХМзЇњпЉМеєіиљїеПЧж£АиАЕзЪДзКґжАБе§Ъж†ЈжАІеСИжШЊиСЧдЄЛйЩНиґЛеКњпЉМиАМеєійХњеПЧж£АиАЕзЪДзКґжАБе§Ъж†ЈжАІдњЭжМБз®≥еЃЪпЉИеЫЊ1DпЉЙгАВйТИеѓєзФЈжАІеТМе•≥жАІзЪДеНХзЛђеИЖжЮРж®°еЮЛжШЊз§ЇпЉМдЄКињ∞еєіиљїеТМеєійХњиАЕзЪДеЈЃеЉВжШѓзФ±зФЈжАІй©±еК®зЪДпЉМеЫ†дЄЇеП™жЬЙ19е≤Бдї•дЄЛзФЈжАІзЪДзКґжАБе§Ъж†ЈжАІйЪПзЭАеєійЊДзЪДеҐЮйХњиАМжШЊиСЧдЄЛйЩНпЉИеЫЊ1EпЉЙгАВињЩи°®жШОзФЈжАІзЪДTзїЖиГЮз®≥жАБеҐЮжЃЦеЬ®жХідЄ™зФЯеСљеС®жЬЯдЄ≠жШѓдЄНеЭЗеМАзЪДгАВеѓєе•≥жАІжЭ•иѓіпЉМеИЖжЃµеЫЮељТеИЖжЮРзЪДеєійЊДеИЖзХМзЇњеЬ®7-8е≤БпЉМдљЖеєіиљїзїДеП™жЬЙ6дЇЇпЉМж®°еЮЛдЄНеЕЈжЬЙзїЯиЃ°е≠¶жДПдєЙпЉИеЫЊ1FпЉЙгАВ
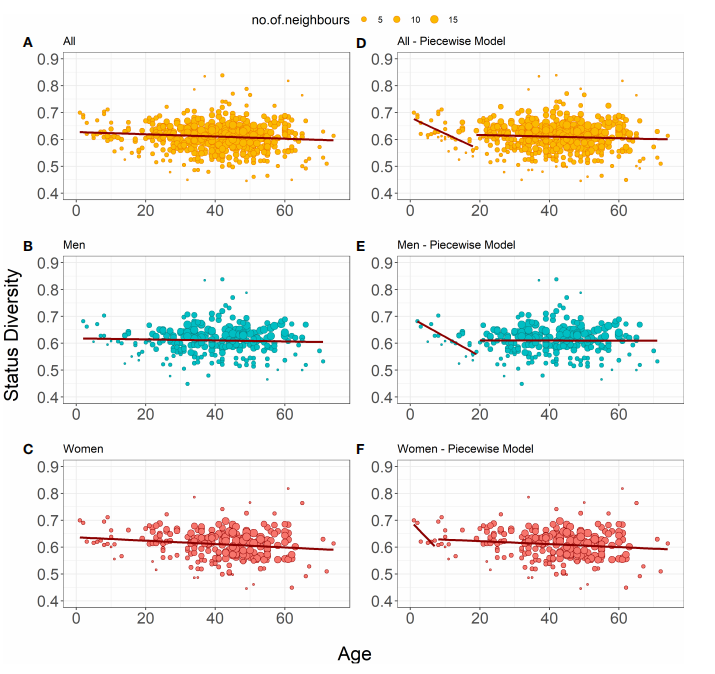
еЫЊ1.зКґжАБе§Ъж†ЈжАІзЪДеК†жЭГзЇњжАІеЫЮељТж®°еЮЛ
ж®™еРСжХ∞жНЃйЫЖдЄ≠пЉМжЙАжЬЙеПЧж£АиАЕзЪДеЇПеИЧе§Ъж†ЈжАІйЪПеєійЊДеҐЮйХњжШЊиСЧйЩНдљОпЉИеЫЊ2AпЉЙпЉМзФЈжАІж®°еЮЛеТМе•≥жАІж®°еЮЛеИЖеИЂеИЖжЮРдєЯжШѓдЄАж†ЈвАФвАФйЪПзЭАеєійЊДеҐЮйХњпЉМе§Ъж†ЈжАІйЩНдљОпЉИеЫЊ2B-CпЉЙпЉМдЇМиАЕзЪДж®°еЮЛз≥їжХ∞еЈЃеЉВдЄНжШЊиСЧгАВињЩеПѓиГљжШѓжКЧеОЯй©±еК®зЪДTжЈЛеЈізїЖиГЮзЊ§еПШеМЦпЉМеЬ®зФЈжАІеТМе•≥жАІдЄ≠еЕЈжЬЙзЫЄеРМзЪДйАЯеЇ¶гАВ
еѓєеЇПеИЧе§Ъж†ЈжАІињЫи°МеИЖжЃµеЫЮељТеИЖжЮРеПСзО∞пЉМеєійЊДеИЖзХМзЇњеЬ®17е≤БпЉИеЫЊ2DпЉЙпЉМеєіиљїиАЕдЄОеєійХњиАЕзЪДе§Ъж†ЈжАІеЭЗйЪПеєійЊДзЪДеҐЮйХњиАМжШЊиСЧдЄЛйЩНпЉМеЬ®еєіиљїиАЕдЄ≠дЄОеєійЊДзЪДзЫЄеЕ≥жАІжЫійЂШпЉИr=-0.416 vs r
=-0.226пЉЙгАВеНХзЛђзФЈжАІзЪДеИЖжЃµеЫЮељТж®°еЮЛжШЊз§ЇпЉМ18е≤Бдї•дЄКеПЧж£АиАЕзЪДеЇПеИЧе§Ъж†ЈжАІйЪПеєійЊДеҐЮйХњиАМйЩНдљОпЉМиАМ18е≤Бдї•дЄЛзФЈжАІеЇПеИЧе§Ъж†ЈжАІзЪДдЄЛйЩНеЊИеЊЃдЄНиґ≥йБУпЉИеЫЊ2EпЉЙгАВе•≥жАІдЄАзФЯдЄ≠зЪДеЇПеИЧе§Ъж†ЈжАІйГљеЬ®дЄЛйЩНпЉМдЄФеЬ®жЧ©жЬЯдЄЛйЩНжЫіењЂпЉИеЫЊ2FпЉЙгАВдљЖжШѓеєіиљїиАЕеТМеєійХњиАЕзЪДжЦЬзОЗз≥їжХ∞дєЛйЧіж≤°жЬЙжШЊиСЧеЈЃеЉВпЉМдЄНиЃЇжШѓеУ™дЄ™ж®°еЮЛгАВеЫ†ж≠§зЛђзЙєTRBеЇПеИЧзЪДеИЖеЄГйЪПзЭАеєійЊДзЪДеҐЮйХњиАМжЫіеК†еЉВиі®пЉМеєійЊДеѓєзФЈжАІеТМе•≥жАІе§ЦеС®TзїЖиГЮеЇУзЪДељ±еУНзЫЄеРМпЉМдЄОдЄАзФЯдЄ≠зЪДеЕЛйЪЖжАІеЈЃеЉВжЧ†еЕ≥гАВ
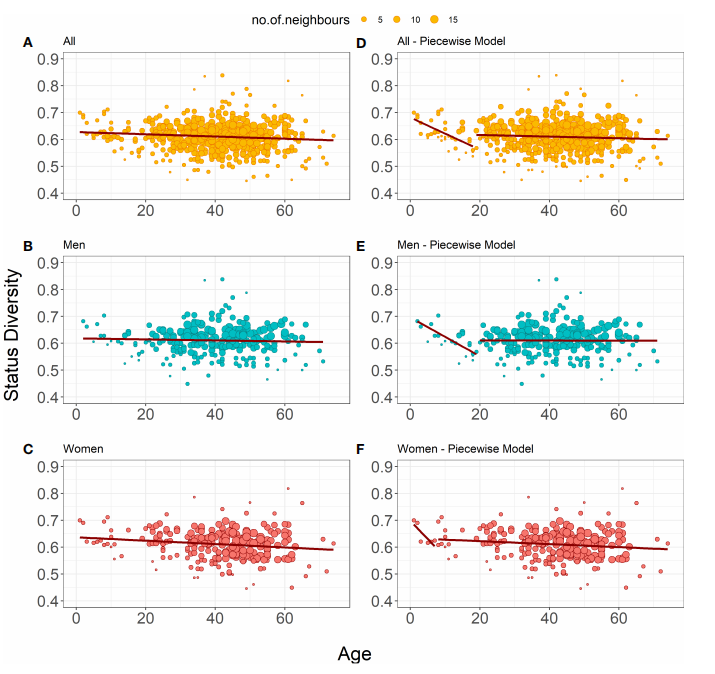
еЫЊ2.еЇПеИЧе§Ъж†ЈжАІзЪДеК†жЭГзЇњжАІеЫЮељТж®°еЮЛ
еЬ®3дЄ™зФЈжАІеТМ3дЄ™е•≥жАІењЧжДњиАЕзїДжИРзЪДзЇµеРСжХ∞жНЃйЫЖдЄ≠пЉМеЬ®зФЈжАІдЄ≠иІВеѓЯеИ∞зКґжАБе§Ъж†ЈжАІйЪПзЭАеєійЊДзЪДеҐЮйХњиАМзХ•жЬЙеҐЮеК†пЉМе•≥жАІзЪДзКґжАБе§Ъж†ЈжАІйЪПеєійЊДеҐЮйХњиАМйЩНдљОгАВе•≥жАІзЪДеє≥еЭЗеИЭеІЛзКґжАБе§Ъж†ЈжАІжЫійЂШгАВеИЭеІЛзКґжАБе§Ъж†ЈжАІеЬ®зФЈжАІдЄ≠еЈЃеЉВе§ІдЇОе•≥жАІпЉМиѓіжШОзФЈжАІе§ЦеС®и°АжЈЛеЈізїЖиГЮдЄ≠зФЯдЇІжАІTRBйЗНжОТйҐСзОЗзЪДдЄ™дљУйЧіеЈЃеЉВжЫіе§ІпЉИеЫЊ3A-BпЉЙ.зФЈжАІеТМе•≥жАІдєЛйЧізЪДдЄНеРМеПШеМЦеПѓиГљдЄїи¶БзФ±дЇЇйЩЕеЈЃеЉВпЉИinterpersonal differencesпЉЙжЭ•иІ£йЗКпЉИеРМз±їзЫЄеЕ≥з≥їжХ∞ICC=95.9%пЉЙгАВињЩдЇЫзїУжЮЬеЬ®дЄ™дљУж∞іеє≥дЄКиѓБеЃЮдЇЖж®™еРСз†Фз©ґдЄ≠иІВеѓЯеИ∞зЪДзФЈжАІеТМе•≥жАІTжЈЛеЈізїЖиГЮз®≥жАБзЪДдЄНеРМжЉФеПШгАВ
зЇµеРСжХ∞жНЃйЫЖдЄ≠еЇПеИЧе§Ъж†ЈжАІзЪДдЄЛйЩНеЬ®зФЈжАІеТМе•≥жАІдЄ≠зЫЄдЉЉпЉМдљЖзФЈжАІзЪДеє≥еЭЗе§Ъж†ЈжАІж∞іеє≥жЫійЂШпЉМдЄїи¶БзЪДеПШеМЦдєЯеПѓдї•зФ®дЇЇйЩЕеЈЃеЉВжЭ•иІ£йЗКпЉИICC=71.1%пЉЙгАВињЩдЇЫеПСзО∞еРМж†ЈдєЯиѓБеЃЮдЇЖж®™еРСз†Фз©ґдЄ≠иОЈеЊЧзЪДдЄ§зІНжАІеИЂзЪДзїУжЮЬгАВпЉИеЫЊ3C-DпЉЙ
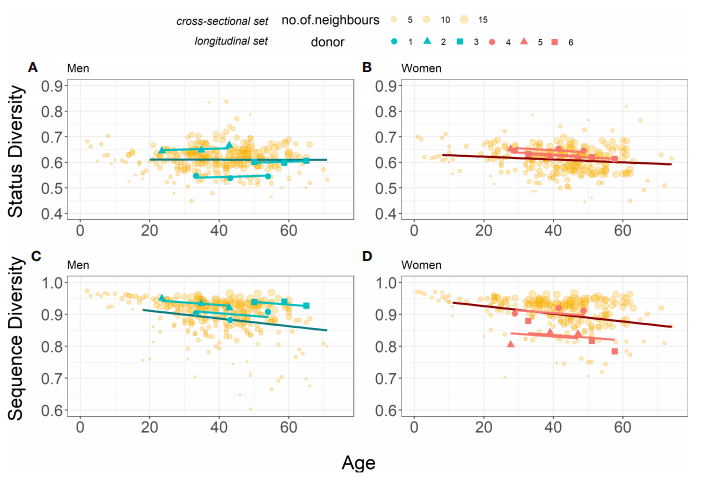
еЫЊ3.ж®™еРСеТМзЇµеРСжХ∞жНЃйЫЖе§Ъж†ЈжАІзЪДжѓФиЊГ
ж≥®пЉЪйїДиЙ≤зЪДзВєдї£и°®ж®™еРСжХ∞жНЃйЫЖпЉМжЈ±иУЭиЙ≤еТМжЈ±зЇҐиЙ≤зЪДзЇњдї£и°®ж®™еРСз†Фз©ґдЄ≠зФЈжАІеТМе•≥жАІзЪДзЇњжАІж®°еЮЛпЉЫжµЕиУЭиЙ≤еТМжµЕзЇҐиЙ≤зЪДзЇњдї£и°®зЇµеРСз†Фз©ґдЄ≠зЪДж®°еЮЛгАВ
еНХзЛђеИЖжЮРCD4+еТМCD8+TзїЖиГЮTRBйЗНжОТзЪДзКґжАБеТМеЇПеИЧе§Ъж†ЈжАІпЉМеПСзО∞е•≥жАІзЪДзКґжАБе§Ъж†ЈжАІйЪПеєійЊДзЪДеҐЮйХњиАМйЩНдљОпЉМзФЈжАІеИЩзЫЄеПНпЉМдЄОеЙНйЭҐзЪДзїУжЮЬзЫЄдЄАиЗігАВе•≥жАІCD4+TзїЖиГЮеТМCD8+TзїЖиГЮзЪДеє≥еЭЗеИЭеІЛзКґжАБе§Ъж†ЈжАІжЫійЂШпЉИеЫЊ4A-BпЉЙпЉМе§ІйГ®еИЖеПѓзФ±дЇЇйЩЕеЈЃеЉВиІ£йЗКпЉИICC=63.3%пЉЙпЉМдЄАйГ®еИЖзФ±зїЖиГЮз±їеЮЛеЈЃеЉВиІ£йЗКпЉИICC=30.5%пЉЙгАВ
CD4+TзїЖиГЮеТМCD8+TзїЖиГЮзЪДеЇПеИЧе§Ъж†ЈжАІеИЩйЪПжЧґйЧіжО®зІїдї•дЄНеРМзЪДжЦєеЉПињЫеМЦпЉИеЫЊ4C-DпЉЙгАВCD8+TзїЖиГЮзЪДеЇПеИЧе§Ъж†ЈжАІеЬ®зФЈжАІеТМе•≥жАІдЄ≠йЪПжЧґйЧіжА•еЙІдЄЛйЩНпЉМиАМиѓ•жМЗжХ∞еЬ®CD4+TзїЖиГЮдЄ≠йЭЮеЄЄз®≥еЃЪгАВзФЈжАІзЪДеє≥еЭЗеИЭеІЛеЇПеИЧе§Ъж†ЈжАІйЂШдЇОе•≥жАІпЉМдЄїи¶БзФ±зїЖиГЮи∞±з≥їеЈЃеЉВиІ£йЗКпЉИICC=80%пЉЙгАВеЫ†ж≠§пЉМеѓєдЇОжѓПдЄ™еПЧж£АиАЕжЭ•иѓіпЉМеЬ®20еєіеЖЕпЉМзЛђзЙєзЪДзФЯдЇІжАІйЗНжОТTRBеЇПеИЧеЬ®CD8+TзїЖиГЮдЄ≠зЪДеИЖеЄГиґКжЭ•иґКеЉВиі®пЉМдљЖеЬ®CD4+TзїЖиГЮдЄ≠дњЭжМБдЄНеПШгАВ
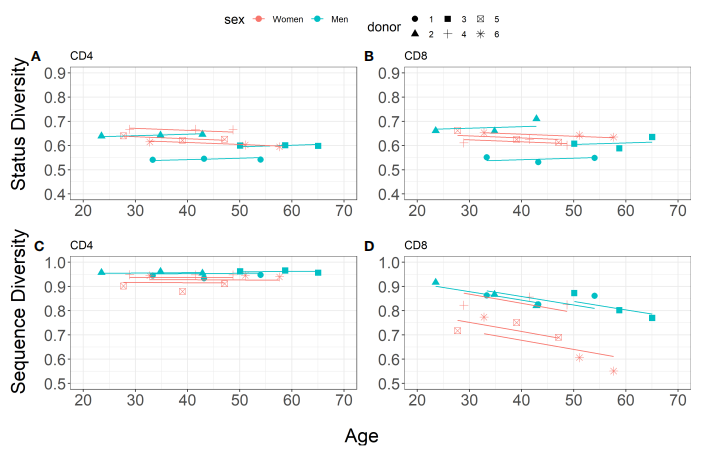
 
еЫЊ4.CD4+еТМCD8+TзїЖиГЮзЪДеЇУе§Ъж†ЈжАІеИЖжЮР
зїУеРИжЧҐеЊАзЪДз†Фз©ґеТМжЦЗзМЃжК•йБУпЉМдљЬиАЕиЃ§дЄЇйЪПзЭАеєійЊДзЪДеҐЮйХњпЉМзКґжАБе§Ъж†ЈжАІзЪДжАІеИЂзЙєеЉВжАІжЉФеПШдЄОжАІжњАзі†жЬЙеЕ≥пЉМжАІжњАзі†ељ±еУНеЕНзЦЂз≥їзїЯзЪДеПСиВ≤еТМеКЯиГљжіїеК®гАВеЇПеИЧе§Ъж†ЈжАІйЪПеєійЊДдЄЛйЩНжШѓжДПжЦЩдєЛдЄ≠зЪДпЉМеЫ†дЄЇеЕНзЦЂз≥їзїЯжФґеИ∞жКЧеОЯзЪДеИЇжњАеПСзФЯеЕНзЦЂеЇФз≠ФеПНеЇФпЉМTзїЖиГЮе§ІйЗПеЕЛйЪЖеҐЮжЃЦпЉМиАМеРОеПШжИРиЃ∞ењЖTзїЖиГЮеЕЛйЪЖгАВеЇПеИЧе§Ъж†ЈжАІдїЕеЬ®еєіиљїе•≥жАІдЄ≠жА•еЙІдЄЛйЩНпЉМиАМеЬ®17е≤Бдї•дЄЛзЪДзФЈжАІдЄ≠дЄЛйЩНдЄНжШОжШЊпЉМйЙідЇОеРМдЄАжЧґжЬЯеЬ®зФЈжАІдЄ≠иІВеѓЯеИ∞зЪДTRBпЉИ+/GLпЉЙзЪДдЉШеЕИеҐЮжЃЦпЉМжЙАдї•жЦ∞зФЯжИРзЪДиЃ∞ењЖTзїЖиГЮеЕЛйЪЖеѓєеЕЛйЪЖе§Іе∞ПеИЖеЄГзЪДељ±еУНеПѓиГљеПѓдї•йАЪињЗеєЉз®ЪTжЈЛеЈізїЖиГЮзЪДжМБзї≠еҐЮжЃЦжЭ•и°•еБњгАВељУеєЉз®ЪзїЖиГЮзЪДеИЖи£ВйАЯзОЗеЗПжЕҐеРОпЉМеЕЛйЪЖе§Іе∞ПеИЖеЄГжЙНеПШеЊЧжЫіеК†еЉВиі®гАВ
еИЖжЮРTзїЖиГЮTRBеЯЇеЫ†еЇУзЪДеКЯиГљзКґжАБеТМе§Ъж†ЈжАІжЬЙеК©дЇОзРЖиІ£еЕНзЦЂз≥їзїЯеЬ®зЙєеЃЪзЧЕзРЖзФЯзРЖжЭ°дїґеТМи°∞иАБдЄ≠зЪДдљЬзФ®пЉМжЫійЂШзЪДе§Ъж†ЈжАІдЄОжЫіеБ•еЇЈзЪДеЕНзЦЂз≥їзїЯеТМжЫійХњзЪДйҐДжЬЯеѓњеСљжЬЙеЕ≥гАВ
жЦЗзМЃжЭ•жЇРпЉЪMika J, Yoshida K, Kusunoki Y, Cand√©ias SM, Polanska J. Sex- and age-specific aspects of human peripheral T-cell dynamics. Front Immunol. 2023 Oct 13;14:1224304.
Immun-Cheq¬Ѓ¬†| TзїЖиГЮеЕНзЦЂжµЛиѓДеЯЇдЇОеЕНзЦЂзїДдЇМдї£йЂШйАЪйЗПжµЛеЇПжКАжЬѓеє≥еП∞пЉМеИ©зФ®еИЖз¶їеРОзЪДTзїЖиГЮзЪДеПЧдљУќ≤йУЊRNAдљЬдЄЇж®°зЙИпЉМйЕНеРИ5вАЩRACEиБЪеРИйЕґйУЊеЉПеПНеЇФжКАжЬѓжЭ•ж£АжµЛжЬЙеКЯиГљзЪДTзїЖиГЮеПЧдљУзЪДV-(D)-JеЯЇеЫ†йЗНзїДпЉМйАЪињЗињЫи°МжЈ±еЇ¶еЯЇеЫ†жµЛеЇПпЉМеєґдљњзФ®дЄЦзХМеЕИињЫзЪДзФЯзЙ©дњ°жБѓе≠¶еИЖжЮРзЃЧж≥ХеѓєжХ∞жНЃињЫи°МеИЖжЮРпЉМиЃ©еЃҐжИЈзЪДеЕНзЦЂеКЫжХ∞е≠ЧеМЦгАВ
йАЪињЗеИЖжЮРеЕ≠е§ІжМЗж†ЗпЉМеПНжШ†еПЧж£АиАЕеЕНзЦЂз≥їзїЯеБ•еЇЈзКґеЖµдЄОеЕНзЦЂеЇФжњАзКґеЖµгАВ
 
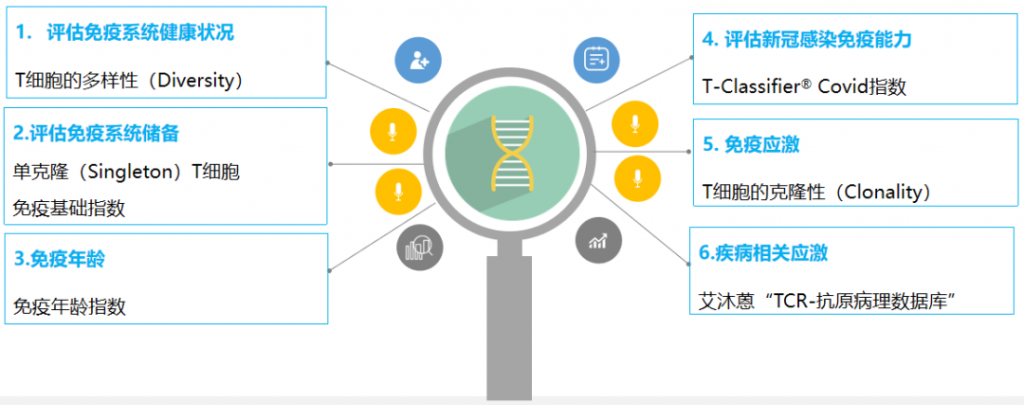
 
 
Immun-Cheq¬ЃеЕНзЦЂеКЫеПѓиІЖеМЦжК•еСКеЫЊз§Ї
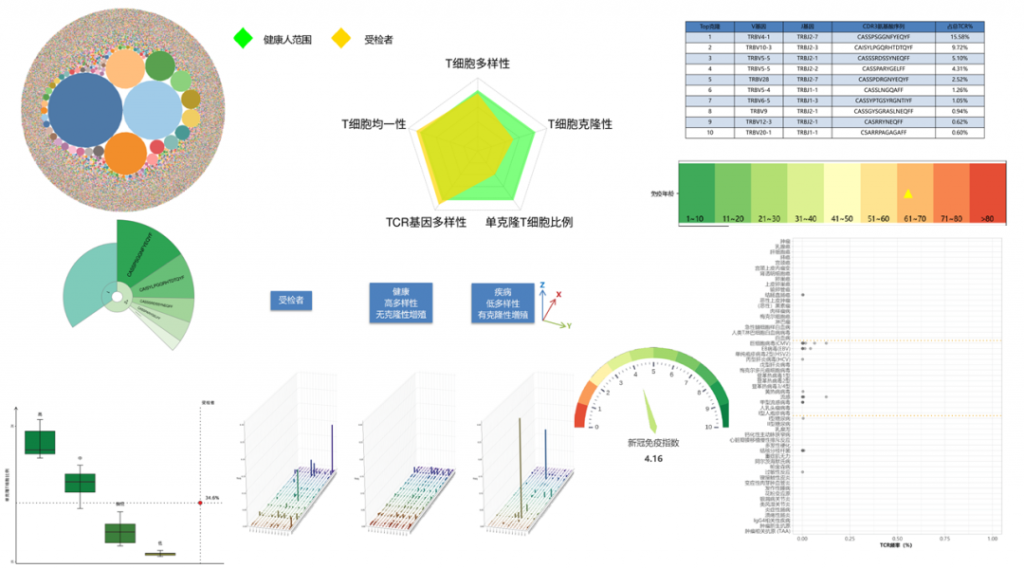
 
 
йАЪињЗж£АжµЛеИ∞зЪДTзїЖиГЮпЉИTCRеЇУпЉЙе§Ъж†ЈжАІпЉМеПНжШ†еЕНзЦЂз≥їзїЯеѓєжКЧеОЯзЪДеЇФз≠ФиГљеКЫпЉМTзїЖиГЮе§Ъж†ЈжАІиґКйЂШпЉМеЕНзЦЂз≥їзїЯиґКеБ•еЇЈпЉМиґКжЬЙиГљеКЫжКµеЊ°зЦЊзЧЕгАВ
йАЪињЗзЛђжЬЙзЪДTCRеїЇеЇУжКАжЬѓжЦєж≥ХиГље§ЯиЊГдЄЇеЗЖз°ЃеПНеЇФеИЭеІЛTзїЖиГЮжѓФдЊЛгАВеЬ®иГЄиЕЇдЄ≠еПСиВ≤жИРзЖЯзЪДеИЭеІЛTзїЖиГЮиГље§ЯиѓЖеИЂйЩМзФЯзЦЊзЧЕжКЧеОЯпЉМеПНжШ†еЕНзЦЂз≥їзїЯеВ®е§ЗиГљеКЫгАВ
еЕНзЦЂеєійЊДжШѓж†єжНЃдЄНеРМеєійЊДжЃµеБ•еЇЈдЇЇзЊ§ељҐжИРзЪДеЕНзЦЂTCRзЙєеЊБеЫЊи∞±пЉМйАЪињЗиѓ•ж®°еЮЛиЃ°зЃЧеЕНзЦЂзЙєеЊБеЬ®иѓ•еЕНзЦЂеєійЊДеЫЊи∞±дЄКзЪДеИЖеЄГдљНзљЃпЉМдїОиАМеЊЧеИ∞еЕНзЦЂеєійЊДгАВ
еЕНзЦЂеєійЊДиГље§ЯиѓДдЉ∞еТМйЗПеМЦеЕНзЦЂи°∞иАБз®ЛеЇ¶дї•еПКдЄОзФЯзЙ©еєійЊДзЪДеЈЃеЉВпЉМеПѓдї•еЗЖз°ЃдЇЖиІ£дЇЇдљУеЕНзЦЂзКґжАБгАВ
жЦ∞еЖ†жДЯжЯУеЕНзЦЂжМЗжХ∞T-Classifier¬Ѓ¬†CovidиГљеПНжШ†иЇЂдљУеЖЕжЦ∞еЖ†зЧЕжѓТзЙєеЉВжАІTзїЖиГЮзЪДеЕЛйЪЖжГЕеЖµпЉМеМЕжЛђжО•зІНжЦ∞еЖ†зЦЂиЛЧеРОжИЦиЗ™зДґжДЯжЯУжЦ∞еЖ†еРОзЪДдЇЇзЊ§зЙєеЉВжАІиЃ∞ењЖTзїЖиГЮпЉМдї•еПКжЬ™жО•зІНзЦЂиЛЧжИЦжДЯжЯУеЙНдЇЇзЊ§зЪДжЦ∞еЖ†еЕНзЦЂеВ®е§ЗпЉМдїОиАМиѓДдЉ∞еПЧж£АиАЕеѓєжЦ∞еЖ†зЪДеЕНзЦЂиГљеКЫгАВ
 
TзїЖиГЮпЉИTCRпЉЙеЕЛйЪЖжАІеПНжШ†еЕНзЦЂз≥їзїЯиѓЖеИЂзЦЊзЧЕжКЧеОЯеРОзЪДеЇФжњАзКґеЖµгАВзФ±дЇОTCRиѓЖеИЂзЦЊзЧЕжКЧеОЯйЭЮеЄЄжХПжДЯпЉМзФЪиЗ≥иГље§Яж£АжµЛеИ∞жЧ†жШОжШЊдЄіеЇКзЧЗзКґзЪДжљЬеЬ®иЇЂдљУзЦЊзЧЕдњ°еПЈгАВ
еП¶е§ЦжИСдїђињШйАЪињЗеѓєжѓФиЙЊж≤РиТљвАЬTCR-жКЧеОЯзЧЕзРЖжХ∞жНЃеЇУвАЭињЫи°Ме§ЪзІНзЦЊзЧЕзЫЄеЕ≥TCRз≠ЫйАЙпЉМж£АжµЛжДЯжЯУињЗзЪДзЦЊзЧЕпЉМдї•йШ≤еЖНжђ°жДЯжЯУгАВ
| йА†и°Аеє≤зїЖиГЮзІїж§НеРОжВ£иАЕ | иѓДдЉ∞еЕНзЦЂйЗНеїЇ |
|
еЕ≥ж≥®жЦ∞еЖ†жДЯжЯУеЕНзЦЂиГљеКЫзЪДдЇЇзЊ§ |
иѓДдЉ∞еѓєжЦ∞еЖ†зЪДеЕНзЦЂиГљеКЫпЉМзФ®дЇОеН±йЗНзЧЗйҐДи≠¶й£ОйЩ©иѓДдЉ∞ |
пЉИ1пЉЙж£АжµЛжµБз®ЛпЉЪ
 
пЉИ2пЉЙж†ЈжЬђи¶Бж±ВпЉЪ
5mlеЈ¶еП≥и°Ажґ≤ж†ЈжЬђпЉИEDTAжКЧеЗЭзЃ°пЉЙпЉМ 4¬∞C ињРиЊУпЉМ24-48hеЖЕйАБиЊЊгАВ
пЉИ3пЉЙж£АжµЛеС®жЬЯпЉЪ
жФґеИ∞ж†ЈжЬђеРОпЉМ15дЄ™еЈ•дљЬжЧ•еЖЕеЗЇеЕЈзїУжЮЬжК•еСКгАВ
搥ињОжЙЂжППдЄЛжЦєдЇМзїіз†БжЈїеК†пЉМиБФз≥їеҮ胥иЙЊж≤РиТљдЇІеУБзїПзРЖпЉЪдљЩиАБеЄИ
 

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ
 
