
新抗原疫苗在治疗晚期癌症方面具有显著潜力,但许多新抗原的免疫原性较差,因为存在于肿瘤和淋巴结中的免疫抑制因子损害了癌症新抗原疫苗的疗效。
2024年11月22日第二军医大学第一附属医院联合温州医科大学第一附属医院在Neoplasia杂志发表题为“Depletion of regulatory T cells enhances the T cell response induced by the neoantigen vaccine with weak immunogenicity”的文章,提出一种调节性T细胞(Treg)耗竭策略,可以使免疫原性差的新抗原能够引发强大的免疫反应,从而增强新抗原疫苗抗肿瘤功效。该研究采用了艾沐蒽ImmuHub®TCR测序分析技术证明了该Treg耗竭策略联合新抗原疫苗有助于诱导新抗原特异性T细胞(NRT)克隆增殖和肿瘤抗原扩散。
研究方法
作者构建了LLC和ID8两种小鼠肿瘤模型,将荷瘤小鼠随机分为4组,分别接受PBS、新抗原疫苗(Vac)、Treg耗竭(LD-CTX+CD25mAb )、联合治疗(Vac+LD-CTX+ CD25mAb )(图1)。监测小鼠的肿瘤生长和生存时间;使用 ELISPOT 测定和 TCR 测序评估了NRT 细胞的扩增和肿瘤抗原扩散;使用转录组测序和流式细胞术来检测治疗小鼠在基因和蛋白质水平上的免疫细胞变化。
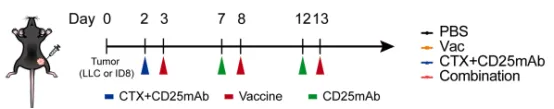
图1
研究结果
01Treg耗竭方案将”较弱“的新抗原转化为”较强“的新抗原
首先作者测试了新抗原肽疫苗对LLC和ID8肿瘤的疗效,检测新抗原疫苗诱导的免疫反应。发现近一半的新抗原未能诱导强大的T细胞免疫反应,尤其是在ID8肿瘤内。
作者考虑存在于外周循环中的免疫抑制性Treg细胞抑制了新抗原肽诱导的NRT细胞的产生,从而导致近一半的新抗原肽表现出较弱的免疫原性,因此使用LD-CTX+CD25mAb来消耗外周循环中的 Tregs,以增强新抗原肽疫苗引发的 T 细胞免疫反应。
ELISPOT测定显示,与疫苗组和PBS组相比,LD-CTX+CD25mAb组表现出更多的斑点,在联合组中观察到IFN-γ斑点的平均数量显著增加,尤其是在那些先前表征为免疫原性差的新抗原中。这些结果表明,减轻Tregs的抑制作用可以将“较弱”的新抗原转化为“较强”的新抗原,从而使新抗原引发的NRT细胞恢复活力。这种作用最终会提高荷瘤宿主对新抗原疫苗的整体反应。02消耗Tregs可增强新抗原疫苗的抗肿瘤功效
经过三轮治疗后,LD-CTX+CD25mAb和联合治疗组的肿瘤生长均显著受到抑制,在终点测量的肿瘤重量中观察到类似的结果。与其他组相比,联合治疗组的小鼠存活率明显改善。在终点对肿瘤切片进行显微镜检查以评估肿瘤内的T细胞浸润。与PBS组和疫苗组相比,联合治疗增加了浸润CD4+和CD8+T细胞的数量。这些结果表明,LD-CTX+CD25mAb增强了新抗原疫苗的抗肿瘤功效。03Treg耗竭方案上调TDLN内免疫反应基因的表达
淋巴结是疫苗诱导的免疫反应的反射指标,对携带左侧腹股沟肿瘤的小鼠的肿瘤引流淋巴结(TDLNs)进行转录组测序。CIBERSORT 分析得出了15个免疫细胞群的相对百分比,与其他组相比,联合组的Tregs比例明显较低,Th1细胞水平较高(图2A)。ssGSEA 免疫细胞分析显示出一致的结果,表明联合组中CD4+和CD8+中枢记忆T细胞、效应记忆T细胞和活化的树突状细胞水平升高(图2B)。各组之间的标记基因表达显示只有联合组表现出细胞毒性和检查点基因的上调(图2C)。CD8+ T细胞和CD4+ T细胞的所选标记基因的表达差异如图2D所示。在细胞因子基因方面,与疫苗组相比,联合组的与CTL和Th1相关的基因上调,表明TDLN内抗肿瘤CD8+和CD4+ T细胞的激活增强。Treg和效应T细胞标志基因的主成分分析 (PCA)显示联合组在Dim1上表现出差异(图2E)。
上述结果表明,在TDLNs中,LD-CTX+CD25mAb可以上调抗肿瘤效应T细胞中的基因表达,同时降低Treg基因表达,这在抑制免疫反应中起着关键作用。
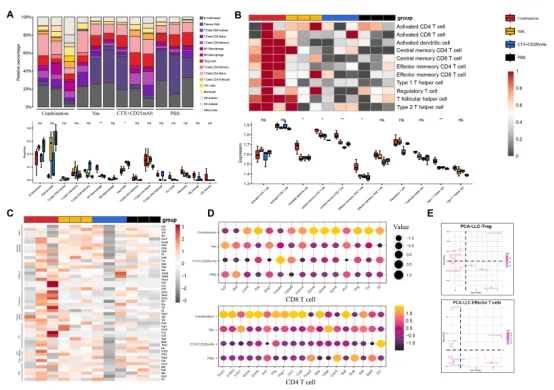
图204联合方案改变了Tregs和抗肿瘤效应T细胞的比例
为了研究四组免疫细胞比例的差异,作者在蛋白质水平上检测了各种免疫细胞群的标志物。首先评估了第二轮治疗后3天收集的 TDLN中iTreg群体的变化。与疫苗组和PBS组相比,联合方案显著降低了CD4+CD25+ T细胞和CD4+Foxp3+ iTregs的百分比(图3A和 B)。此外,联合组CD25+Foxp3+与CD25+Foxp3- 的比率低于疫苗组,间接表明Treg耗竭后CD4+效应T细胞增加(图3C)。
然后检查了第二轮治疗后第7天收集的TDLN内的效应细胞和记忆T 细胞群。LD-CTX+CD25mAb增加了联合组内CD4+和CD8+ T细胞中效应记忆表型(CD44+CD62L-)的比例(图3D和E)。此外,联合组产生CD4+(Th1)和CD8+(CTL)T 细胞的IFN-γ比例增加,说明联合疗法增强了新抗原疫苗诱导的效应 T 细胞的产生(图3F和G)。在体外肿瘤细胞杀伤试验中,IFN-γ 和TNF-α ELISA 分析进一步证实了细胞因子分泌的增加(图3H)。
这些结果表明,LD-CTX+CD25mAb可以有效减少新抗原疫苗诱导的Tregs增加,并且这种联合方案促使抗肿瘤效应细胞和记忆细胞的显著扩增,这可能有利于肿瘤宿主的长期生存。
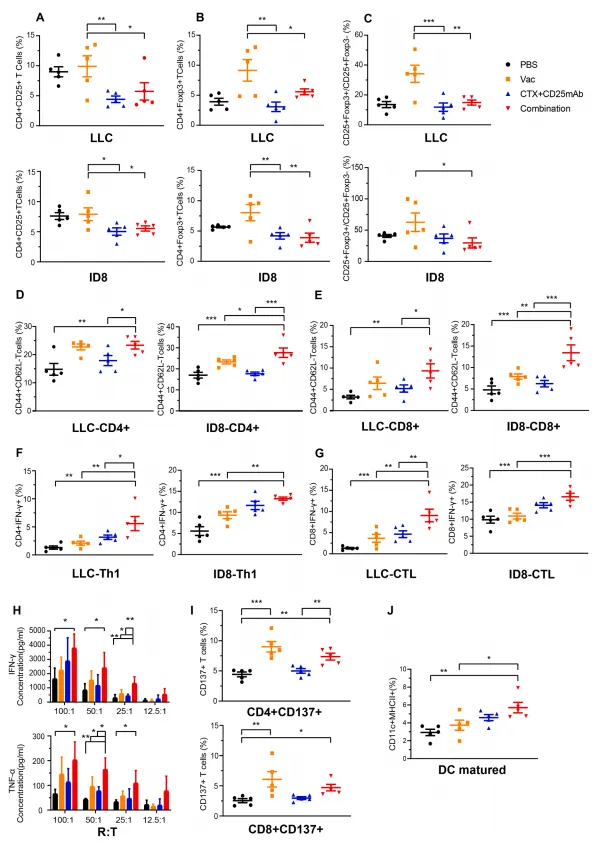
图3
05联合方案促进NRT细胞增殖和肿瘤抗原扩散
从LLC模型小鼠中分离的TDLN用于TCR测序。观察到联合组中的 TRBV基因片段数量较高(图4A)。与Vac组相比,联合组的 V、J基因片段种类更多,配对的V-J类型也更多(图4B),两组之间重叠的基因片段数量为33个(图4C)。图4D的共享克隆分析显示,联合组的3个样品仅共享18个克隆,而在Vac组内共享的克隆数高达 3915个。克隆性和多样性指数分析显示,联合疗法促进了专注于特定抗原的TCR的克隆扩增,减少了一部分TCR多样性(图4E)。
作者对包含新抗原和肿瘤相关抗原(TAA)的MHC-I新抗原肽进行了表位预测,然后,这些表位用于TCR 亲和力预测。根据结合评分选择候选抗原特异性TCR克隆。在联合组中,4个新抗原特异性 TCR克隆的比例高于Vac组(图4F)。在 TAA-TCR结合亲和力分析中也出现了相同的趋势(图4G)。这表明与疫苗组相比,联合治疗具有更高的促进肿瘤抗原扩散的潜力。图4H展示了联合组和疫苗组中每种MHC-I新抗原的前10个常见TCR-CDR3序列。这些发现表明,LD-CTX+CD25mAb可以通过消耗Tregs来诱导新抗原特异性T 细胞克隆的增殖,从而促进肿瘤抗原的扩散。
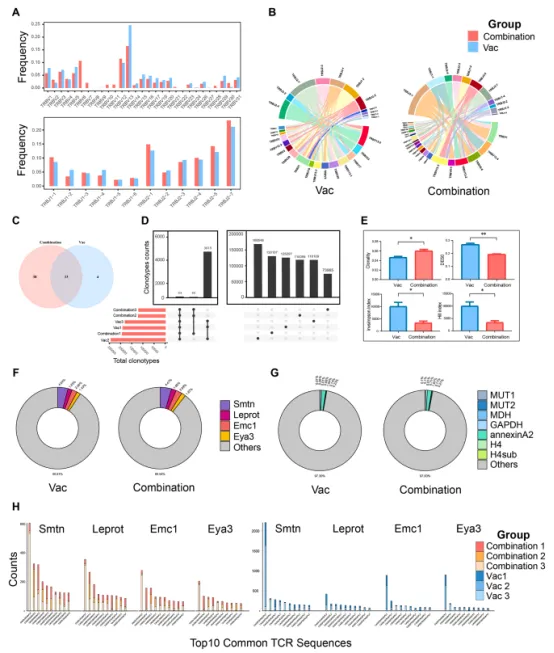
图4
研究结论
该研究揭示了抑制Tregs的正常功能将“较弱”的新抗原转化为“较强”的新抗原,同时也有助于NRT 细胞的增殖。这种Treg 耗竭方案与新抗原疫苗相结合有效增加了记忆和效应T 细胞的数量,促进了肿瘤抗原的扩散,从而抑制了肿瘤生长并延长了宿主的存活时间。
通过艾沐蒽ImmuHub®TCR测序分析技术表明该联合治疗方案有效诱导了新抗原特异性T细胞克隆的增殖,增强了T细胞抗肿瘤效应。
