ињСеєіжЭ•ињЗзїІзїЖиГЮзЦЧж≥ХпЉИACTпЉЙењЂйАЯеПСе±ХпЉМеМЕжЛђCAR-TгАБTCR-TгАБTILзЦЧж≥Хз≠ЙдЄЇж≤їжДИзЩМзЧЗеЄ¶жЭ•жЧ†йЩРеЄМжЬЫгАВдљЖеЃЮдљУиВњзШ§еЕНзЦЂеЊЃзОѓеҐГдЉЪжКСеИґACTзЦЧж≥ХзЪДжКЧиВњзШ§иГљеКЫпЉМе¶ВдљХеЕЛжЬНиВњзШ§иѓ±еѓЉзЪДеЕНзЦЂжКСеИґжШѓжПРйЂШACTж≤їзЦЧжХИжЮЬзЪДеЕ≥йФЃгАВдЄКжµЈдЇ§йАЪе§Іе≠¶зОЛдЄЦжИРз≠ЙдЇЇеЬ®Cancer Immunol ImmunotherдЄКеПСи°®йҐШдЄЇвАЬCryo-thermal therapy reshaped the tumor immune microenvironment to enhance the efficacy of adoptive T cell therapyвАЭзЪДжЦЗзЂ†пЉМиѓ•з†Фз©ґеПСзО∞еЖЈеЖїзГ≠зЦЧпЉИCTTпЉЙеПѓдї•йЗНе°СиВњзШ§еЕНзЦЂеЊЃзОѓеҐГпЉМеҐЮеЉЇACTж≤їзЦЧзЦЧжХИпЉМйАЪињЗйЗЗзФ®иЙЊж≤РиТљImmuHub¬ЃTCRжµЛеЇПеИЖжЮРеє≥еП∞еПСзО∞CTTиБФеРИACTзЦЧж≥ХиГље§ЯеҐЮеК†иВњзШ§еЖЕзЙєеЃЪTзїЖиГЮеЕЛйЪЖзЪДжѓФдЊЛпЉМињЩеПѓиГљжЬЙеК©дЇОжПРйЂШж≤їзЦЧжХИжЮЬгАВ

з†Фз©ґзїУжЮЬ дљњзФ®жµБеЉПзїЖиГЮжЬѓж£АжЯ•жО•еПЧдЄНеРМж≤їзЦЧеРОе∞ПйЉ†ињЬзЂѓиВњзШ§еЖЕеЕИ姩еЕНзЦЂзїЖиГЮзЪД浪洶гАВдљЬиАЕеПСзО∞пЉМеЕИ姩еЕНзЦЂзїЖиГЮпЉМеМЕжЛђеЧЬдЄ≠жАІз≤ТзїЖиГЮгАБеЈ®еЩђзїЖиГЮеТМDCпЉМжЧ©еЬ®CTTеРО24е∞ПжЧґе∞±еЬ®иВњзШ§еЖЕжШЊиСЧеҐЮеК†пЉИеЫЊ1FпЉЙгАВйАЪињЗеЕНзЦЂзїДеМЦжЯУиЙ≤еПСзО∞пЉМдЄОеѓєзЕІзїДзЫЄжѓФпЉМCTTеРОCD11b+й™®йЂУзїЖиГЮзЪД浪洶еҐЮеК†пЉИеЫЊ1GпЉЙгАВињЩдЇЫзїУжЮЬи°®жШОпЉМCTTиѓ±еѓЉдЇЖжА•жАІзВОзЧЗеПНеЇФпЉМдњГињЫдЇЖеЕИ姩еЕНзЦЂзїЖиГЮзЪД浪洶пЉМдїОиАМйЗНе°СдЇЖињЬзЂѓиВњзШ§зЪДеЕНзЦЂзОѓеҐГгАВ01CTTйЗНе°СињЬзЂѓиВњзШ§еЕНзЦЂеЊЃзОѓеҐГдљЬиАЕйАЪињЗеЬ®е∞ПйЉ†зЪДеП≥дЊІеТМеЈ¶дЊІеИЖеИЂжО•зІН5√Ч105еТМ104дЄ™ B16F10зїЖиГЮжЭ•еїЇзЂЛеПМдЊІиВњзШ§ж®°еЮЛгАВжО•зІНеРО12姩пЉМеѓєеП≥дЊІпЉИе§ІпЉЙиВњзШ§ињЫи°МCTTпЉМеЬ®CCTеРО7姩жФґйЫЖеЈ¶дЊІпЉИе∞ПпЉЙиВњзШ§ињЫи°МRNAжµЛеЇП пЉИRNA-seqпЉЙпЉИеЫЊ1AпЉЙгАВдЄОжЬ™ж≤їзЦЧзЪДеѓєзЕІзїДзЫЄжѓФпЉМCTTзїДеЈ¶дЊІиВњзШ§зЪДеЯЇеЫ†и°®иЊЊи∞±еПСзФЯдЇЖжШЊиСЧеПШеМЦпЉМ336дЄ™еЯЇеЫ†дЄКи∞ГпЉМ142дЄ™еЯЇеЫ†дЄЛи∞ГпЉИеЫЊ1B-CпЉЙгАВеЈ¶иВњзШ§дЄ≠еРМзІНеЉВдљУзІїж§НзЙ©жОТжЦ•еПНеЇФгАБеє≤жЙ∞зі† ќ± еТМ ќ≥ еПНеЇФгАБзВОзЧЗеПНеЇФеТМ IL-6/JAK/STAT3 дњ°еПЈйАЪиЈѓжШЊиСЧеѓМйЫЖпЉИеЫЊ1DпЉЙгАВеРМжЧґпЉМеЈ¶дЊІиВњзШ§дЄ≠дЄ≠жАІз≤ТзїЖиГЮиґЛеМЦжАІгАБињБзІїгАБе§ЦжЄЧеТМеНХж†ЄзїЖиГЮињБзІїйАФеЊДдї•еПКеЈ®еЩђзїЖиГЮзЪДжіїеМЦеТМM1жЮБеМЦдї•еПКеЈ®еЩђзїЖиГЮеТМж†Сз™БзКґзїЖиГЮпЉИDCпЉЙйАФеЊДдЄ≠зЪДзїЖиГЮеЫ†е≠РдЇІзФЯдЄНеПЧи∞ГиКВпЉИеЫЊ1EпЉЙгАВ
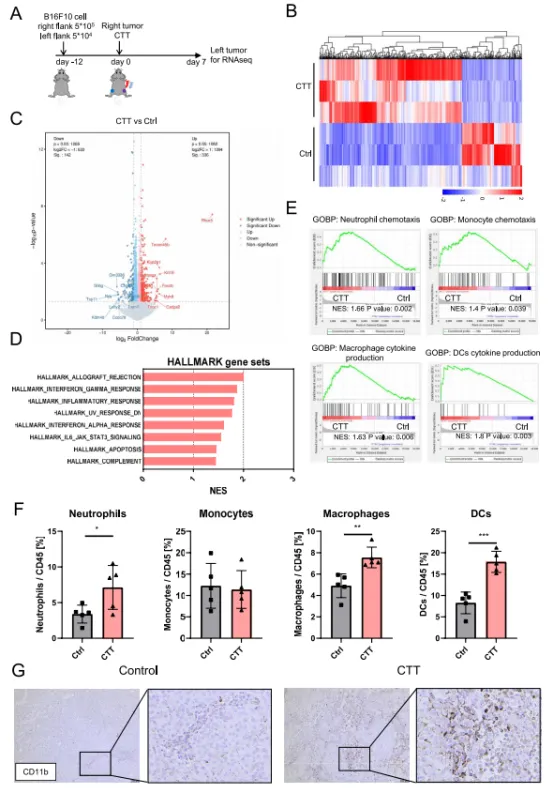
еЫЊ1 еЬ®CTTеРО14姩жФґйЫЖе∞ПйЉ†иДЊTзїЖиГЮињЫи°МдљУе§ЦеИЇжњАжЙ©еҐЮпЉМйАЪињЗжµБеЉПзїЖиГЮжЬѓињЫдЄАж≠•иѓДдЉ∞CTTеРОжЙ©еҐЮзЪДиДЊTзїЖиГЮзЪДеКЯиГљгАВеЫЊ2A-Bе±Хз§ЇдЇЖCD 4+еТМCD 8+дЄ≠CD 69гАБIFN-ќ≥гАБз©ње≠Фзі†еТМйҐЧз≤ТйЕґBзЪДи°®иЊЊпЉМдЄОжЙ©еҐЮеЙНTзїЖиГЮзЫЄжѓФпЉМдљУе§ЦжЙ©еҐЮеРОзЪДTзїЖиГЮйЂШеЇ¶жіїеМЦгАВдљЬиАЕеБЗиЃЊжЭ•иЗ™жО•еПЧCTTзЪДе∞ПйЉ†зЪДжЙ©еҐЮзЪДиДЊTзїЖиГЮиГље§ЯдљЬдЄЇACTзЪДзїЖиГЮжЭ•жЇРгАВдЄЇдЇЖй™МиѓБACTеЬ®дљУеЖЕзЪДжКЧиВњзШ§еКЯжХИпЉМе∞ЖжЙ©еҐЮзЪДиДЊTзїЖиГЮињЗзїІиљђзІїеИ∞еПМдЊІе∞ПйЉ†иВњзШ§ж®°еЮЛдЄ≠пЉМеєґеЬ®CTTеРО7姩йАЪињЗHEжЯУиЙ≤иѓДдЉ∞еЈ¶дЊІиВњзШ§зЪДеЭПж≠їпЉИеЫЊ2CпЉЙгАВжЭ•иЗ™еНХзЛђACTж≤їзЦЧзЪДе∞ПйЉ†зЪДиВњзШ§ж≤°жЬЙеЭПж≠їпЉМдљЖиБФеРИж≤їзЦЧзїДиІВеѓЯеИ∞еЃЮиі®жАІеЫЇзЉ©гАБж†ЄзҐОи£ВеТМж†ЄжЇґиІ£пЉМиѓіжШОеЉХиµЈдЇЖиВњзШ§еєњж≥ЫеЭПж≠їпЉИеЫЊ2DпЉЙгАВзїУжЮЬи°®жШОпЉМCTTиГљжЬЙжХИеҐЮеЉЇACTзЪДжКЧиВњзШ§дљЬзФ®гАВ02
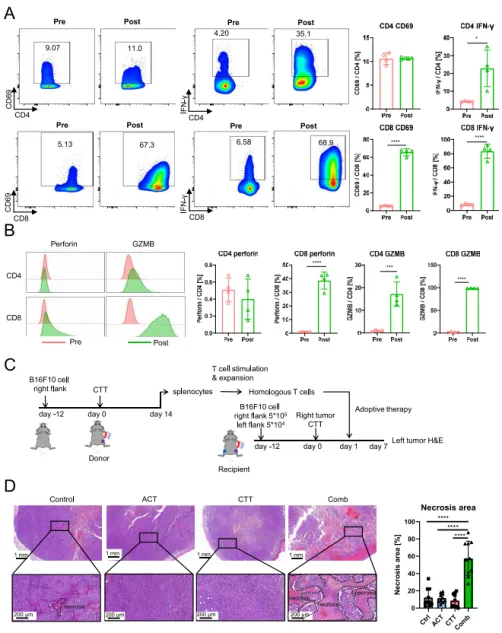
еЫЊ2
дЄЇдЇЖињЫдЄАж≠•з†Фз©ґCTTеҐЮеЉЇACTжКЧиВњзШ§иГљеКЫзЪДеЕНзЦЂе≠¶жЬЇеИґпЉМеЬ®CTTеРОзђђ7姩僺жЭ•иЗ™еѓєзЕІзїДгАБCTTзїДгАБACTзїДеТМиБФеРИж≤їзЦЧзїДзЪДеЈ¶дЊІиВњзШ§ињЫи°МRNA-seqгАВдЄОеНХзЛђзЪДACTзЫЄжѓФпЉМзїДеРИзЦЧж≥ХжШЊиСЧдЄКи∞ГеЈ¶дЊІиВњзШ§дЄ≠зЪДеє≤жЙ∞зі†ќ≥еТМќ±еЇФз≠ФгАБеРМзІНеЉВдљУзІїж§НзЙ©жОТжЦ•гАБзВОзЧЗеЇФз≠ФеТМIL-6/JAK/STAT 3дњ°еПЈдЉ†еѓЉйАФеЊДпЉИеЫЊ3AпЉЙгАВеРМжЧґпЉМиБФеРИж≤їзЦЧзїДдЄ≠зЪДеЧЬдЄ≠жАІз≤ТзїЖиГЮгАБеНХж†ЄзїЖиГЮеТМеЈ®еЩђзїЖиГЮиґЛеМЦйАФеЊДдї•еПКDCдЄ≠зЪДзїЖиГЮеЫ†е≠РдЇІзФЯйАФеЊДеѓМйЫЖпЉИеЫЊ3BпЉЙгАВињЩдЇЫзїУжЮЬеЖНжђ°иѓБеЃЮдЇЖCTTйЗНе°СдЇЖињЬзЂѓиВњзШ§зЪДеЕНзЦЂзОѓеҐГгАВж≠§е§ЦпЉМдЄОACTеНХиНѓж≤їзЦЧзЫЄжѓФпЉМиБФеРИж≤їзЦЧзїДдЄ≠дЄОжКЧеОЯеК†еЈ•еТМеСИйАТйАФеЊДзЫЄеЕ≥зЪДеЯЇеЫ†жШЊиСЧеѓМйЫЖгАВ(еЫЊ3CпЉЙгАВзДґеРОйАЪињЗжµБеЉПзїЖиГЮжЬѓжµЛйЗПиВњзШ§еЖЕжКЧеОЯеСИйАТзїЖиГЮдЄКMHC-IIзЪДи°®иЊЊгАВдЄОеѓєзЕІзїДзЫЄжѓФпЉМеП™жЬЙиБФеРИж≤їзЦЧзїДдЄ≠жШЊз§ЇеЗЇDCгАБеНХж†ЄзїЖиГЮеТМеЈ®еЩђзїЖиГЮдЄКMHC-IIи°®иЊЊзЪДжШЊиСЧдЄКи∞ГпЉИеЫЊ3D-FпЉЙгАВеЫ†ж≠§пЉМеЬ®CTTдїЛеѓЉзЪДиВњзШ§еЕНзЦЂзОѓеҐГйЗНе°СдєЛеРОпЉМиБФеРИж≤їзЦЧињЫдЄАж≠•еҐЮеЉЇдЇЖеЕИ姩еЕНзЦЂзїЖиГЮзЪДжКЧеОЯеСИйАТеКЯиГљгАВ03
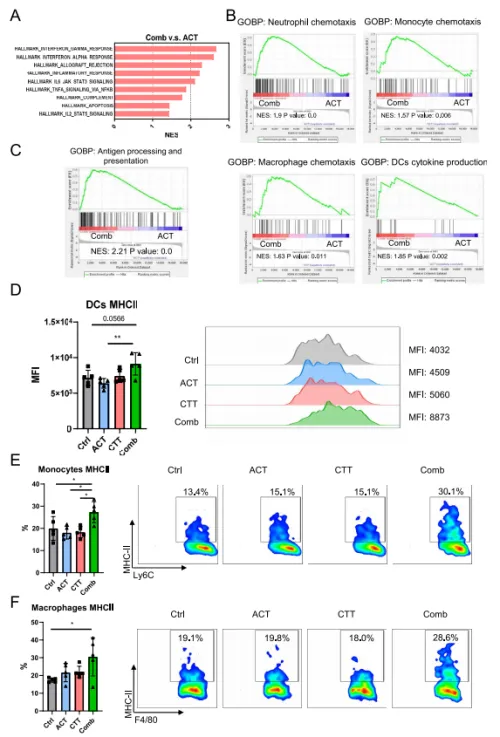
еЫЊ3
04 дљњзФ®GSEAеИЖжЮРGOзФЯзЙ©ињЗз®ЛеЯЇеЫ†йЫЖдЄ≠зЪДTзїЖиГЮзЫЄеЕ≥еЕНзЦЂйАФеЊДгАВдЄОеНХзЛђACTзЫЄжѓФпЉМиБФеРИж≤їзЦЧзїДдЄ≠TзїЖиГЮдїЛеѓЉзЪДеЕНзЦЂеТМзїЖиГЮжѓТжАІйАФеЊДеєњж≥ЫдЄНеПЧи∞ГиКВпЉИеЫЊ4AпЉЙгАВдЄФиБФеРИж≤їзЦЧеРОиВњзШ§дЄ≠CD 4+TзїЖиГЮеТМCD8+TзїЖиГЮзЪДжѓФдЊЛжШЊиСЧеҐЮеК†пЉИеЫЊ4BпЉЙгАВињЩеПѓиГљељТеЫ†дЇОеЃГдїђзЪДжіїиЈГеҐЮжЃЦпЉМеЫ†дЄЇCD4+еТМCD8+TзїЖиГЮеЖЕKi 67зЪДи°®иЊЊжШЊиСЧеҐЮеК†пЉИеЫЊ4CпЉЙгАВеЕНзЦЂзїДеМЦжЯУиЙ≤жШЊз§ЇпЉМдЄОеП¶дЄАзїДзЫЄжѓФпЉМиБФеРИж≤їзЦЧеРОиВњзШ§еЖЕCD3+TзїЖиГЮзЪДжХ∞йЗПжШЊзЭАеҐЮеК†пЉИеЫЊ4DпЉЙгАВдЄОеѓєзЕІзїДеТМCTTзїДзЫЄжѓФпЉМеЬ®иБФеРИж≤їзЦЧзїДдЄ≠иІВеѓЯеИ∞иВњзШ§еЖЕCD62вИТCD44+жХИеЇФиЃ∞ењЖTзїЖиГЮпЉИTEMпЉЙзЪДжѓФдЊЛжШЊиСЧеҐЮеК†пЉИеЫЊ4EпЉЙгАВеРМжЧґпЉМиБФеРИж≤їзЦЧжШЊз§ЇеЗЇIFN-ќ≥гАБйҐЧз≤ТйЕґBеТМз©ње≠Фзі†еЬ®CD8+TзїЖиГЮдЄ≠зЪДи°®иЊЊжШЊиСЧеҐЮеК†пЉИеЫЊ4FпЉЙгАВзЉЦз†БйҐЧз≤ТйЕґеТМз©ње≠Фзі†зЪДеЯЇеЫ†е¶ВGZMAгАБGZMBгАБGZMGеТМPRF1зЪДи°®иЊЊеЬ®иБФеРИж≤їзЦЧеРОдєЯеҐЮеК†пЉИеЫЊ4GпЉЙгАВињЩдЇЫзїУжЮЬи°®жШОпЉМиБФеРИж≤їзЦЧеПѓдї•ињЫдЄАж≠•дњГињЫTзїЖиГЮзЪДеҐЮжЃЦеТМжХИеЇФеКЯиГљпЉМеѓЉиЗіTзїЖиГЮдїЛеѓЉзЪДжКЧиВњзШ§еЕНзЦЂзЪДжЬАе§ІеМЦгАВ
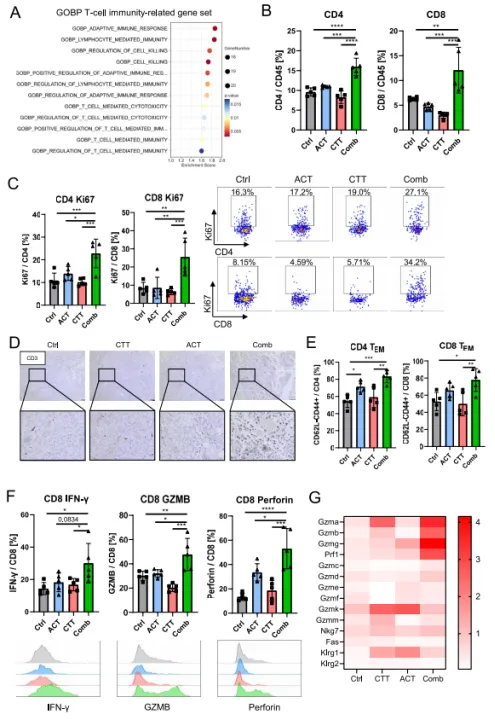
еЫЊ4
05 TзїЖиГЮеПЧдљУпЉИTCRпЉЙеЖ≥еЃЪTзїЖиГЮзЪДзЙєеЉВжАІпЉМдљЬиАЕеЬ®CTTеРОзђђ7姩僺僺зЕІзїДгАБACTгАБCTTеТМиБФеРИж≤їзЦЧзїДзЪДеЈ¶дЊІиВњзШ§ињЫи°МTCRќ≤жµЛеЇПгАВACTеТМCTTе∞Жtop5 TCRеЕЛйЪЖзЪДйҐСзОЗеИЖеИЂдїО9.78жШЊиСЧеҐЮеК†иЗ≥17.35%еТМ15.49%пЉМиАМиБФеРИж≤їзЦЧињЫдЄАж≠•еҐЮеК†дЇЖtop5 TCRеЕЛйЪЖзЪДйҐСзОЗпЉИ22.09%пЉЙпЉИеЫЊ5AпЉЙгАВеРМжЧґпЉМиБФеРИж≤їзЦЧдЄ≠зЪДTOP5 TCRеЕЛйЪЖеПѓдї•еЬ®еЕґдїЦзїДзЪДиВњзШ§дЄ≠ж£АжµЛеИ∞пЉМињЩи°®жШОињЩдЇЫжЙ©еҐЮзЪДTCRеЕЛйЪЖеЕЈжЬЙжљЬеЬ®зЪДиВњзШ§зЙєеЉВжАІпЉИеЫЊ5BпЉЙгАВињЩдЇЫзїУжЮЬи°®жШОиБФеРИж≤їзЦЧдњГињЫдЇЖиВњзШ§еЖЕTзїЖиГЮзЪД浪洶еТМжЙ©еЉ†гАВ
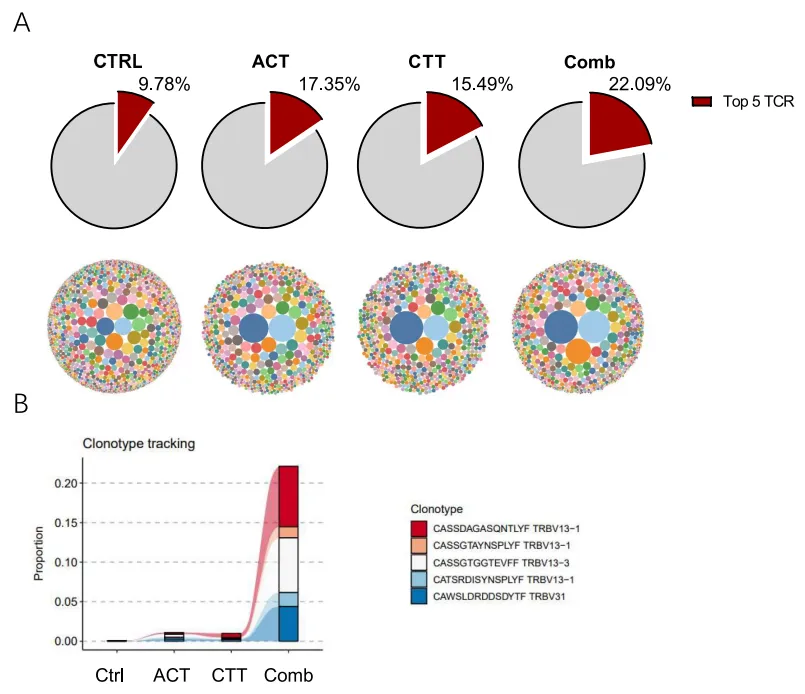
еЫЊ5
дЄЇдЇЖињЫдЄАж≠•иѓБжШОиБФеРИзЦЧж≥ХзЪДж≤їзЦЧеКЯжХИпЉМзФ®CTTж≤їзЦЧеПМдЊІиНЈзШ§е∞ПйЉ†B16 F10зЪДеП≥дЊІиВњзШ§дљЬдЄЇйЭґзЧЕзБґпЉМеєґдЄФе∞ЖеЈ¶дЊІиВњзШ§зФ®дљЬиІВеѓЯзЧЕзБґдї•зЫСжµЛиВњзШ§е§Іе∞ПгАВжЙ©еҐЮжЭ•иЗ™CTTе§ДзРЖзЪДе∞ПйЉ†зЪДиДЊTзїЖиГЮпЉМеєґеЬ®CTTе§ДзРЖеРО1姩иЊУж≥®дЇОе∞ПйЉ†пЉИеЫЊ6AпЉЙгАВеНХзЛђзЪДACTдЄНиГљжКСеИґиІВеѓЯзЧЕеПШзЪДзФЯйХњпЉМCTTе§ДзРЖзЪДе∞ПйЉ†жШЊз§ЇеЗЇиІВеѓЯеИ∞зЪДзЧЕеПШзФЯйХњиљїеЊЃеЗПе∞СпЉМдљЖж≤°жЬЙжШЊиСЧеЈЃеЉВпЉМиАМиБФеРИж≤їзЦЧжШЊиСЧжКСеИґдЇЖеЈ¶дЊІиІВеѓЯеИ∞зЪДзЧЕеПШзЪДзФЯйХњпЉИеЫЊ6BпЉЙгАВдЄЇдЇЖй™МиѓБиБФеРИж≤їзЦЧеѓєжБґжАІиВњзШ§зЪДзЦЧжХИпЉМдљњзФ®дЇЖ4T1е∞ПйЉ†дє≥иЕЇзЩМж®°еЮЛпЉМдЄОеѓєзЕІе∞ПйЉ†зЫЄжѓФпЉМCTTжШЊиСЧжПРйЂШдЇЖе∞ПйЉ†зЪДе≠ШжіїзОЗпЉИеЫЊ6CпЉЙгАВеЬ®йХњжЬЯиІВеѓЯжЬЯеЖЕпЉМдЄОеНХзЛђзЪДCTTзЫЄжѓФпЉМиБФеРИж≤їзЦЧе∞Же∞ПйЉ†зЪДе≠ШжіїзОЗдїОзЇ¶50%еҐЮеК†иЗ≥зЇ¶90%пЉИеЫЊ6CпЉЙгАВињЩдЇЫжХ∞жНЃи°®жШОпЉМиБФеРИж≤їзЦЧеПѓдї•йЩРеИґињЬзЂѓиВњзШ§зФЯйХњеєґжґИйЩ§еЊЃиљђзІїгАВ06
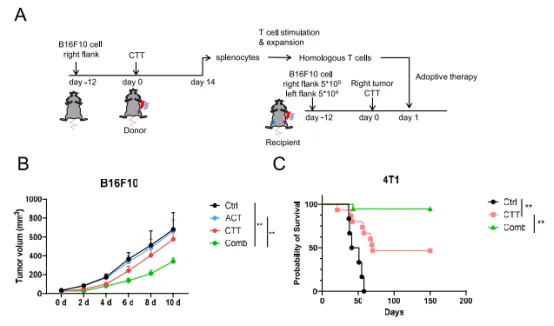
еЫЊ6 йАЪињЗиЙЊж≤РиТљImmuHub¬ЃTCRжµЛеЇПжКАжЬѓжΥ糥дЇЖTзїЖиГЮеЕНзЦЂзОѓеҐГзЪДеПШеМЦпЉМиѓБжШОдЇЖCCTиБФеРИACTж≤їзЦЧжЫіиГљжњАжіїTзїЖиГЮеЕЛйЪЖжЙ©еҐЮпЉМеПСжМ•жКЧиВњзШ§дљЬзФ®гАВ
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖжХ∞еНБзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪThe New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ
