иґКжЭ•иґКе§ЪзЪДз†Фз©ґиѓБжШОдЉ†жЯУзЧЕзЪДзЧЕзРЖжЬЇеИґдЄОеЕНзЦЂз≥їзїЯжБѓжБѓзЫЄеЕ≥пЉМеЫ†ж≠§еЕНзЦЂзїДжµЛеЇПеЬ®дЉ†жЯУзЧЕз†Фз©ґдЄ≠зЪДеЇФзФ®иґКжЭ•иґКеєњж≥ЫеТМйЗНи¶БгАВ2024еєі12жЬИ21жЧ•е§НжЧ¶е§Іе≠¶жЦєйТЯжХЩжОИеЫҐйШЯеЬ®жЯ≥еПґеИАе≠РеИКEBioMedicineпЉИIFпЉЪ11.2пЉЙдЄКеПСи°®йҐШдЄЇвАЬCombination of spatial transcriptomics analysis and retrospective study reveals liver infection of SARS-COV-2 is associated with clinical outcomes of COVID-19вАЭзЪДжЦЗзЂ†пЉМиѓ•з†Фз©ґйАЪињЗз©ЇйЧіиљђељХзїДеИЖжЮРгАБеЕНзЦЂзїДеЇУеИЖжЮРеТМдЄіеЇКзЧЕдЊЛеЫЮй°ЊжАІз†Фз©ґзЫЄзїУеРИпЉМжП≠з§ЇдЇЖSARS-CoV-2еѓєиВЭиДПзЪДељ±еУНеєґжΥ糥жљЬеЬ®зЪДжЬЇеИґгАВжЦЗдЄ≠йЗЗзФ®иЙЊж≤РиТљзЪДImmuHub¬ЃTCRжµЛеЇПеИЖжЮРз≥їзїЯпЉМжП≠з§ЇCOVID-19ж≠їдЇ°зЧЕдЊЛдЄОеєЄе≠ШзЧЕдЊЛиВЭиДПзїДзїЗзЪДеЕНзЦЂзЙєеЊБеПКеЈЃеЉВгАВ

з†Фз©ґзїУжЮЬ
01COVID-19жВ£иАЕиВЭиДПдЄ≠зЪДSARS-CoV-2зЪДз©ЇйЧіжЩѓиІВ
й¶ЦеЕИдљЬиАЕеЬ®SARS-CoV-2жДЯжЯУдїУйЉ†зЪДиВЭиДПдЄ≠ж£АжµЛеИ∞SARS-CoV-2 SеТМNиЫЛзЩљпЉМдљњзФ®жКЧзЧЕжѓТSжИЦNиЫЛзЩљжКЧдљУеѓєдЄіеЇКзЧЕдЊЛиВЭзїДзїЗж†ЈеУБињЫи°МжЯУиЙ≤пЉМеЬ®йЗНзЧЗжВ£иАЕеТМжЙАжЬЙе∞Єж£АзЪДиВЭзїДзїЗдЄ≠ж£АжµЛеИ∞SеТМNиЫЛзЩљпЉМиАМеЬ®дЄ≠еЇ¶зЦЊзЧЕжВ£иАЕзЪДиВЭиДПжИЦдєЩеЮЛиВЭзВОеѓєзЕІзїДзїЗдЄ≠жЬ™ж£АжµЛеИ∞гАВињЩи°®жШОпЉМиВЭиДПдЄ≠зЪДзЧЕжѓТжФїеЗїдЄОCOVID-19зЪДдЄ•йЗНз®ЛеЇ¶жЬЙеЕ≥гАВ
зДґеРОеИЖжЮРдЇЖдЄАдЊЛдЄ≠еЇ¶гАБдЄАдЊЛйЗНеЇ¶еТМдЄАдЊЛеЈ≤жХЕжВ£иАЕзЪДиВЭиДПзїДзїЗдЄ≠зЪДз©ЇйЧіиљђељХзїДгАВеЈ≤жХЕзЧЕдЊЛж†ЈжЬђеЕ±зФЯжИРдЇЖ4981дЄ™жЦСзВєпЉМеИЖдЄЇеНБдЄ™з∞ЗпЉИеЫЊ1cпЉЙпЉЫйЗНеЇ¶зЧЕдЊЛзФЯжИРдЇЖ751дЄ™жЦСзВєпЉМеИЖдЄЇдЇФдЄ™з∞ЗпЉИеЫЊ1bпЉЙпЉЫдЄ≠еЇ¶зЧЕдЊЛзФЯжИРдЇЖ271дЄ™жЦСзВєпЉМеИЖдЄЇдЄЙдЄ™з∞ЗпЉИеЫЊ1aпЉЙгАВдїЕеЬ®йЗНзЧЗжВ£иАЕеТМеЈ≤жХЕжВ£иАЕдЄ≠ж£АжµЛеИ∞SARS-CoV-2 RNAпЉМиАМеЬ®дЄ≠еЇ¶жВ£иАЕдЄ≠жЬ™ж£АжµЛеИ∞пЉИеЫЊ1dеТМeпЉЙгАВеЬ®йЗНзЧЗзЧЕдЊЛзЪДжЙАжЬЙз∞ЗдЄ≠еЭЗж£АжµЛеИ∞зЧЕжѓТRNAеєґдЄФеЬ®з∞З2гАБ3еТМ4дЄ≠еРЂйЗПжЫійЂШпЉИеЫЊ2dпЉЙгАВеЬ®еЈ≤жХЕжВ£иАЕзЪДзђђ1иЗ≥9з∞ЗдЄ≠ж£АжµЛеИ∞зЧЕжѓТRNAпЉМеЬ®зђђ3гАБ4гАБ5гАБ8з∞ЗдЄ≠зЧЕжѓТRNAеРЂйЗПиЊГйЂШпЉИеЫЊ1eпЉЙгАВ
еЫЊ1f-lе±Хз§ЇдЇЖдїОеИЗзЙЗдЄ≠иОЈеЊЧзЪДsиЫЛзЩљжЯУиЙ≤ж†ЈеУБзЪДIHCеЫЊеГПпЉМеЬ®йЗНзЧЗзЧЕдЊЛдЄ≠пЉМз∞З 2гАБ3 еТМ 4пЉИеЫЊ 1h-jпЉЙеМЕеРЂжЫіе§ЪзЪДSARS-CoV-2иЫЛзЩљгАВеЬ®ж≠їдЇ°зЧЕдЊЛдЄ≠пЉМзЧЕжѓТиЫЛзЩљи°®иЊЊеЬ®з∞З 3гАБ4гАБ5 еТМ 8 дЄ≠иЊГеЉЇпЉИеЫЊ1o-qеТМtпЉЙгАВињЩдЇЫеПСзО∞и°®жШОSARS-CoV-2еПѓдї•жДЯжЯУиВЭиДПзЪДзЙєеЃЪеМЇеЯЯгАВ
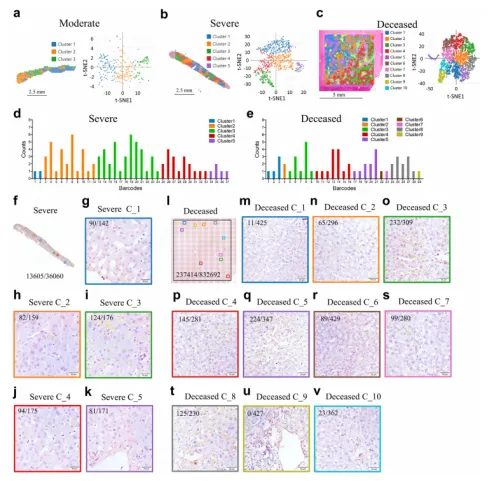
еЫЊ102SARS-CoV-2жДЯжЯУиВЭиДПзЪДиВЭеЖЕеЕНзЦЂзЙєеЊБ
дљЬиАЕж£АжЯ•дЇЖPTPRCзЪДж∞іеє≥пЉМPTPRCзЉЦз†БCD45пЉМCD45жШѓеЕНзЦЂзїЖиГЮзЪДж≥Ыж†ЗењЧзЙ©гАВеЬ®еЈ≤жХЕжВ£иАЕдЄ≠пЉМзЇ¶5%зЪДжЦСзВєжШѓPTPRCйШ≥жАІпЉМеЬ®йЗНзЧЗжВ£иАЕдЄ≠е§ІзЇ¶25.3%зЪДжЦСзВєжШѓPTPRCйШ≥жАІпЉИеЫЊ 2aпЉЙгАВPTPRCи°®иЊЊеЬ®еЈ≤жХЕжВ£иАЕзЪДдїїдљХз∞ЗдЄ≠еЭЗжЬ™еѓМйЫЖпЉМдљЖеЬ®еєЄе≠ШзЪДйЗНзЧЗжВ£иАЕзЪДзђђ2гАБ3гАБ4з∞ЗдЄ≠еѓМйЫЖпЉИеЫЊ2bпЉЙгАВиАМињЩдЇЫз∞ЗдєЯеѓМеРЂзЧЕжѓТRNAпЉМињЩи°®жШОеЕНзЦЂзїЖиГЮеПВдЄОиВЭиДПзЧЕжѓТжОІеИґгАВ
ж≠§е§ЦпЉМињШеИЖжЮРдЇЖеЈ®еЩђзїЖиГЮгАБз≤ТзїЖиГЮгАБ BзїЖиГЮгАБ NKзїЖиГЮеТМTзїЖиГЮзЪДж†ЗиЃ∞еЯЇеЫ†пЉИеЫЊ2c-fпЉЙпЉМињЩдЇЫеЯЇеЫ†еЬ®зЧЕжѓТиЫЛзЩљдЄ∞еѓМзЪДз∞ЗдЄ≠и°®иЊЊж∞іеє≥жШОжШЊеҐЮеК†пЉМе∞§еЕґжШѓеЬ®з∞З3дЄ≠гАВзДґеРОдљЬиАЕиѓ±еѓЉCD3еТМзЧЕжѓТN иЫЛзЩљзЪДIFжЯУиЙ≤гАВеЬ®йЗНзЧЗеТМж≠їдЇ°жВ£иАЕзЪДиВЭиДПдЄ≠ж£АжµЛеИ∞зЧЕжѓТNиЫЛзЩљпЉМдљЖеЬ®дЄ≠еЇ¶жВ£иАЕзЪДиВЭиДПдЄ≠жЬ™ж£АжµЛеИ∞пЉИеЫЊ2gпЉЙгАВеЬ®еєЄе≠ШзЪДйЗНзЧЗжВ£иАЕдЄ≠пЉМжЫіе§ЪзЪДCD3+зїЖиГЮдЄОзЧЕжѓТйШ≥жАІзїЖиГЮзЫЄйВїпЉМдљЖеЬ®еЈ≤жХЕжВ£иАЕдЄ≠еИЩж≤°жЬЙпЉИеЫЊ2gпЉЙгАВTCRзЪДзЫЄеЕ≥еЯЇеЫ†еМЕжЛђTRACгАБTRAC1гАБTRBC2еЬ®з∞З3дЄ≠йЂШеЇ¶и°®иЊЊпЉИеЫЊ2hпЉЙгАВ
зДґеРОеѓєFFPEиВЭзїДзїЗињЫи°МдЇЖTCRжµЛеЇПпЉМдї•жѓФиЊГйЗНзЧЗжВ£иАЕеТМеЈ≤жХЕжВ£иАЕдєЛйЧізЪДеЕНзЦЂзЙєеЊБгАВдЄОеЈ≤жХЕжВ£иАЕзЫЄжѓФпЉМеєЄе≠ШйЗНзЧЗжВ£иАЕзЪДTCRќ± йУЊCDR3йХњеЇ¶жЫізЯ≠пЉИеЫЊ2iпЉЙпЉМеЬ®еєЄе≠ШйЗНзЧЗжВ£иАЕдЄ≠еЕЈжЬЙйЂШеЇ¶жЙ©еҐЮзЪДеЕЛйЪЖпЉИеЫЊ2jпЉЙгАВеП¶е§ЦеЬ®еєЄе≠ШзЪДйЗНзЧЗзЧЕдЊЛдЄ≠пЉМиІВеѓЯеИ∞TCRќ≤йУЊV20-1еТМJ207зЪДжЦ∞йЗНзїДпЉИеЫЊ2kпЉЙгАВињЩдЇЫзїУжЮЬи°®жШОпЉМTзїЖиГЮеѓє SARS-CoV-2зЪДиВЭеЖЕжОІеИґиЗ≥еЕ≥йЗНи¶БгАВ
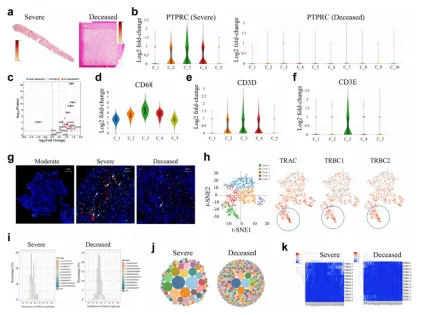
еЫЊ203SARS-CoV-2жДЯжЯУеРОиВЭиДПзЪДеИЖеЄГеТМеПШеМЦ
з©ЇйЧіиљђељХзїДе≠¶еИЖжЮРжШЊз§ЇпЉМдЄ≠еЇ¶гАБйЗНеЇ¶еТМж≠їдЇ°зЧЕдЊЛзЪДж†ЈжЬђз∞ЗдЄ≠еѓМйЫЖдЇЖзЙєеЊБеЯЇеЫ†пЉИеЫЊ3a-cпЉЙгАВеЈ≤жХЕжВ£иАЕзЪДз∞З5еТМ8зЪДзЩљиЫЛзЩљпЉИALBпЉЙж∞іеє≥жШОжШЊйЩНдљОпЉИеЫЊ3eпЉЙпЉМиАМеЬ®йЗНзЧЗзЧЕдЊЛзЪДз∞ЗдЄ≠зЪДALBи°®иЊЊдњЭжМБдЄНеПШпЉИеЫЊ3dпЉЙгАВ
йЪПеРОеѓєALBйЩНдљОзЪДз∞З5еТМ8дЄ≠еЙН1000дЄ™дЄКи∞ГеЯЇеЫ†ињЫи°МдЇЖGOзФЯзЙ©ињЗз®ЛеѓМйЫЖгАВеПСзО∞з∞З5еТМ8зЪДдЄАдЇЫеЯЇеЫ†еЬ®еЗЛдЇ°ињЗз®ЛдЄ≠еѓМйЫЖпЉИеЫЊ3fеТМ gпЉЙгАВж≠§е§ЦпЉМеЬ®з∞З5дЄ≠йЙіеЃЪеЗЇе§ЦжЇРжАІеЗЛдЇ°йАЪиЈѓпЉИеЫЊ3fпЉЙпЉМиАМеЖЕжЇРжАІеЗЛдЇ°йАЪиЈѓеЬ®з∞З8дЄ≠иґЛдЇО襀жњАжіїпЉИеЫЊ3gпЉЙгАВдЄОж∞®еЯЇйЕЄдї£и∞ҐеПКдї£и∞ҐињЗз®ЛзЫЄеЕ≥зЪДеЯЇеЫ†и°®иЊЊеЬ®з∞З5еТМ8дЄ≠еЭЗжШЊиСЧйЩНдљОпЉИеЫЊ3hеТМiпЉЙгАВињЩдЇЫжХ∞жНЃи°®жШОпЉМзФ±дЇОзїЖиГЮж≠їдЇ°пЉМжЙАжЬЙиљђељХжЬђеПѓиГљжЩЃйБНдЄЛйЩНгАВACTBпЉИзЉЦз†Бќ≤-иВМеК®иЫЛзЩљпЉЙеТМTUBBпЉИзЉЦз†Бќ≤-еЊЃзЃ°иЫЛзЩљпЉЙеЬ®еЗЛдЇ°з∞ЗдЄ≠еЭЗеЗПе∞СпЉМе∞§еЕґжШѓеЬ®з∞З5дЄ≠пЉИеЫЊ3jеТМkпЉЙгАВињЩдЇЫеПСзО∞и°®жШОпЉМиВЭзїЖиГЮзЪДиЫЛзЩљиі®еРИжИРеКЯиГљеПЧеИ∞SARS-CoV-2зЪДдЄ•йЗНжНЯеЃ≥пЉМдњГињЫдЇЖеЕґеЬ®еЈ≤жХЕжВ£иАЕдЄ≠зЪДеЗЛдЇ°гАВ
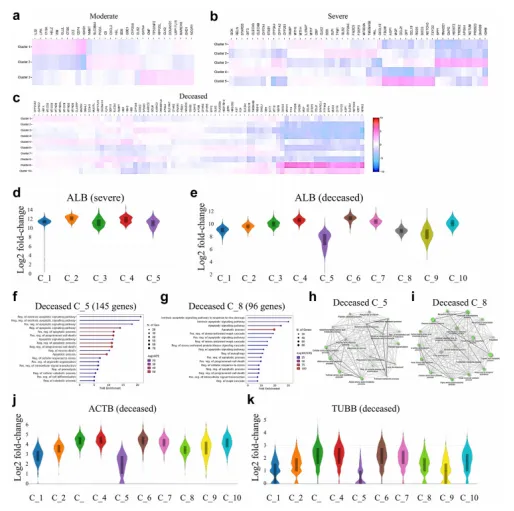
еЫЊ304ALBжµУеЇ¶зЪДеК®жАБж≥ҐеК®дЄОCOVID-19жВ£иАЕзЪДйҐДеРОзЫЄеЕ≥
еЫЮй°ЊжАІз†Фз©ґдЇЖCOVID-19дљПйЩҐжВ£иАЕпЉМеМЕжЛђ165еРНж≠їдЇ°жВ£иАЕпЉМ122еРНйЗНзЧЗжВ£иАЕеТМ363еРНдЄ≠еЇ¶жВ£иАЕгАВж≤°жЬЙиІВеѓЯеИ∞еЈ≤жХЕгАБйЗНеЇ¶еТМдЄ≠еЇ¶йШЯеИЧдєЛйЧізЪДеЯЇзЇњдЄЩж∞®йЕЄж∞®еЯЇиљђзІїйЕґпЉИALTпЉЙжИЦќ≥-и∞Јж∞®йЕ∞иљђзІїйЕґпЉИGGTпЉЙж∞іеє≥жЬЙдїїдљХеЈЃеЉВпЉИеЫЊ4a-cпЉЙгАВ姩еЖђж∞®йЕЄж∞®еЯЇиљђзІїйЕґпЉИASTпЉЙж∞іеє≥йЪПзЭАзЦЊзЧЕдЄ•йЗНз®ЛеЇ¶зЪДеҐЮеК†иАМеҐЮеК†пЉИеЫЊ4bпЉЙгАВзЫЄжѓФдєЛдЄЛпЉМеЯЇзЇњALBжµУеЇ¶йЪПзЭАдЄ•йЗНз®ЛеЇ¶зЪДеҐЮеК†иАМйЩНдљОпЉИеЫЊ4dпЉЙгАВ
зДґеРОж£АжЯ•дЇЖALBж∞іеє≥зЪДж≥ҐеК®гАВжѓПзїДжВ£иАЕALBж≥ҐеК®еПШеМЦиІБеЫЊ4e-gпЉМеЬ®ж≠їдЇ°зїДдЄ≠пЉМALBжµУеЇ¶йЩНиЗ≥ж≠£еЄЄж∞іеє≥дї•дЄЛпЉИеЫЊ4eпЉЙпЉМиАМеЬ®йЗНеЇ¶еТМдЄ≠еЇ¶йШЯеИЧдЄ≠пЉМALBжµУеЇ¶иґЛдЇОеҐЮеК†пЉИеЫЊ4fеТМgпЉЙгАВиµЈзВєеТМзїИзВєдєЛйЧіALBж∞іеє≥зЪДжѓФиЊГи°®жШОпЉМж≠їдЇ°зїДдЄ≠пЉМз†Фз©ґеЉАеІЛжЧґALBж∞іеє≥дЄЛйЩНзЪДжВ£иАЕеЬ®з†Фз©ґзїУжЭЯжЧґж≤°жЬЙжБҐе§НпЉИеЫЊ4hпЉЙпЉМеН≥дљњALBжµУеЇ¶жЬАеИЭжБҐе§Нж≠£еЄЄпЉМеИ∞з†Фз©ґзїУжЭЯжЧґдєЯдЉЪдЄЛйЩНпЉИеЫЊ4iпЉЙгАВзЫЄжѓФдєЛдЄЛпЉМеЬ®е≠ШжіїзЪДжВ£иАЕдЄ≠пЉМALBж∞іеє≥жЬАеИЭдЄЛйЩНзЪДжВ£иАЕеАЊеРСдЇОжБҐе§НпЉИеЫЊ 4jпЉЙпЉМиАМALBж∞іеє≥ж≠£еЄЄзЪДжВ£иАЕдњЭжМБињЩдЄАиґЛеКњзЫіеИ∞з†Фз©ґзїУжЭЯпЉИеЫЊ 4kпЉЙгАВзФ±дЇОиВЭзїЖиГЮзЙєеЉВжАІеРИжИРALBпЉМеЕґеЗПе∞СеПНжШ†дЇЖSARS-CoV-2еѓєиВЭиДПзЪДељ±еУНгАВйЗНи¶БзЪДжШѓпЉМи°АжЄЕALBжµУеЇ¶зЪДж≥ҐеК®еПѓзФ®дЇОиѓДдЉ∞ COVID-19 жВ£иАЕзЪДж≠їдЇ°й£ОйЩ©гАВ

еЫЊ4
з†Фз©ґзїУиЃЇ
иѓ•з†Фз©ґйАЪињЗж£АжµЛзЧЕжѓТRNAеТМ S еТМ N иЫЛзЩљеИЖжЮРдЇЖ SARS-CoV-2 зЪДеЧЬиВЭжАІпЉМжП≠з§ЇдЇЖзЧЕжѓТеЬ®иВЭиДПдЄ≠зЪДз©ЇйЧіеИЖеЄГеТМеЕНзЦЂзЙєеЊБпЉМеєґи°®жШОTCRзЪДеЕЛйЪЖжАІеТМйЗНзїДеѓєдЇОжОІеИґиВЭеЖЕзЧЕжѓТиЗ≥еЕ≥йЗНи¶БгАВињШиѓБжШО SARS-CoV-2 дњГињЫеЈ≤жХЕжВ£иАЕиВЭзїЖиГЮеЗЛдЇ°пЉМдїОиАМеѓЉиЗі ALB и°®иЊЊеПЧжНЯгАВи°АжЄЕ ALB и°®иЊЊзЪДйЩНдљОеПѓзФ®дЇОиѓДдЉ∞жВ£иАЕзЪДж≠їдЇ°й£ОйЩ©гАВеПВиАГжЦЗзМЃ
Chen S, et,al. Combination of spatial transcriptomics analysis and retrospective study reveals liver infection of SARS-COV-2 is associated with clinical outcomes of COVID-19. EBioMedicine. 2024 Dec 21;111:105517. doi: 10.1016/j.ebiom.2024.105517.
иЙЊж≤РиТљдЄУж≥®дЇОеЕНзЦЂзїДжµЛеЇПйҐЖеЯЯе§ЪеєіпЉМеЉАеПСзЪДImmuHub¬ЃжКАжЬѓеє≥еП∞жЦєж≥ХеЕ®йЭҐпЉМж£АжµЛзЙ©зІНе§Ъж†ЈпЉМеїЇеЇУжЦєж≥ХеЕЈжЬЙзБµжіїжАІпЉМиЗіеКЫдЇОдЄЇеРДе§ІйЂШж†°гАБеМїйЩҐгАБзІСз†ФжЬЇжЮДгАБдЉБдЄЪз≠ЙжПРдЊЫдЉШиЙѓзЪДзІСз†ФжЬНеК°гАВ
