
 
еЕНзЦЂзРГиЫЛзЩљйЗНйУЊпЉИIgHпЉЙзЪДйЂШйАЪйЗПжµЛеЇПпЉИHTSпЉЙжШѓдЄАзІНињљиЄ™еЊЃе∞ПжЃЛзХЩзЦЊзЧЕпЉИMRDпЉЙзЪДжХПжДЯжЦєж≥ХгАВйЗЗзФ®жЭ•иЗ™619еРНеДњзЂ•ALLжВ£иАЕзЪДж≤їзЦЧеЙНIgH HTSжХ∞жНЃпЉМињЩдЇЫжВ£иАЕеЬ®COGж†ЗеЗЖй£ОйЩ©пЉИSRпЉЙиѓХй™МAALL0331еТМйЂШй£ОйЩ©пЉИHRпЉЙиѓХй™МAALL0232дЄ≠зїЯдЄАж≤їзЦЧпЉМдљЬиАЕйАЪињЗдЄОзЩљи°АзЧЕзЫЄеЕ≥зЪДIgHеЕЛйЪЖзїДжИРеИЖжЮРдЇЖB-ALLжВ£иАЕзЪДзФЯе≠ШзїУе±АгАВз†Фз©ґеПСзО∞пЉМеЬ®иѓКжЦ≠дЄ≠еПѓж£АжµЛеИ∞зЪДIgHжШЊиСЧжАІеЕЛйЪЖеЇПеИЧзЪДжХ∞йЗПељ±еУНйҐДеРОпЉМзЙєеИЂжШѓеЬ®зЉЇдєПиЙѓе•љзїЖиГЮйБЧдЉ†зЪДHR B-ALLжВ£иАЕдЄ≠гАВињЩи°®жШОж≤їзЦЧеЙНзЪДIgHеЕЛйЪЖзїДжИРеПѓиГљдЄЇзїЖеМЦеН±йЩ©еИЖе±ВжПРдЊЫжЬЇдЉЪгАВ
 
еЬ®bзїЖиГЮеПСиВ≤ињЗз®ЛдЄ≠пЉМIgHзФ±(V)гАБ(D)еТМ(J)еЯЇеЫ†йЗНзїДдЇІзФЯзЛђзЙєзЪДV-DJеЇПеИЧпЉМељУеЕЛйЪЖжЙ©еҐЮжЧґпЉМдЇІзФЯжШЊиСЧжАІеЕЛйЪЖеЇПеИЧпЉМйАЪињЗињЩдЇЫеЇПеИЧеПѓдї•ињљиЄ™зЩљи°АзЧЕзїЖиГЮгАВIgHзїДжИРеПѓиГљдЄОеЕґеЬ®MRDзЫСжµЛдЄ≠зЪДйҐДеРОдљЬзФ®еЕЈжЬЙзЫЄеЕ≥жАІпЉМдљЖињЩдЄАиІВеѓЯзїУжЮЬе∞ЪжЬ™еЬ®дЄіеЇКиѓХй™МдЄ≠еЊЧеИ∞жШОз°Ѓй™МиѓБгАВ
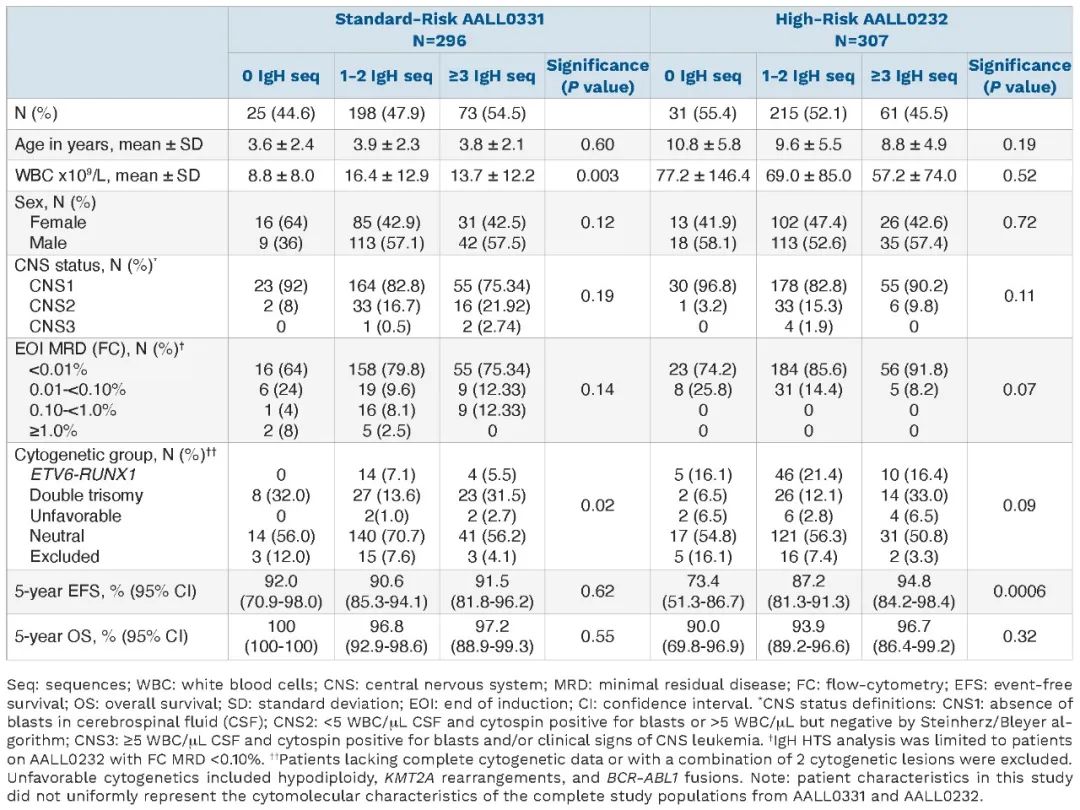
и°®1¬†жВ£иАЕзЙєеЊБгАБIgHзїДжИРеТМзФЯе≠ШзОЗ
дљњзФ®603дЊЛжО•еПЧCOGиѓХй™МзЪДжВ£иАЕзЪДIgH HTSжХ∞жНЃпЉИ97%зЪДn=619жї°иґ≥зЫЃеЙНзЪДHTSиі®йЗПжМЗж†ЗпЉМжЭ•иЗ™AALL0331зЪДn=296пЉЫжЭ•иЗ™AALL0232зЪДn=307пЉЙпЉМдљЬиАЕйАЪињЗIgHзїДжИРеИЖжЮРдЇЖжВ£иАЕзЙєеЊБеТМзФЯе≠ШзїУжЮЬпЉМеПСзО∞IgHзїДжИРдЄОй£ОйЩ©зїДгАБеєійЊДгАБжАІеИЂжИЦдЄ≠жЮҐз•ЮзїПз≥їзїЯзКґжАБдєЛйЧіж≤°жЬЙжШЊиСЧзЪДеЕ≥з≥їгАВзДґиАМпЉМIgHзЪДзїДжИРеЬ®зїЖиГЮйБЧдЉ†зїДдЄ≠з°ЃеЃЮжЬЙжЙАдЄНеРМгАВдЄОеЕґдїЦзїЖиГЮйБЧдЉ†зїДзЫЄжѓФпЉМеПМдЄЙдљУпЉИDTпЉЙжВ£иАЕжАїдљУдЄКжЫіжЬЙеПѓиГљжШЊз§ЇвЙ•3¬†IgHеЇПеИЧпЉИDTпЉЪ37%пЉЫETV6-RUNX1пЉЪ17.7%пЉЫеЕґдїЦ/дЄНеИ©зЪДзїЖиГЮйБЧдЉ†зїДпЉЪ19.6%пЉЙгАВзДґиАМпЉМељУйАЪињЗиѓХй™МеИЖз¶їжЧґпЉМзїЖиГЮйБЧдЉ†е≠¶еТМIgHеЇПеИЧжХ∞йЗПдєЛйЧізЪДзЫЄеЕ≥жАІдїЕеЬ®AALL0331иѓХй™МзЪДжВ£иАЕдЄ≠жЬЙжШЊиСЧжАІпЉИи°®1пЉЙгАВ
IgHеЇПеИЧдЄОEFSзЪДеЕ≥з≥ї
дЄОжЬЙ1-2зїДжШЊиСЧжАІеЕЛйЪЖеЇПеИЧжВ£иАЕеТМвЙ•3зїДжШЊиСЧжАІеЕЛйЪЖеЇПеИЧзЪДжВ£иАЕзЫЄжѓФпЉМжЧ†IgHжШЊиСЧжАІеЕЛйЪЖеЇПеИЧзЪДжВ£иАЕ5еєіжЧ†дЇЛдїґзФЯе≠ШжЬЯпЉИEFSпЉЙиЊГдљОгАВйЂШй£ОйЩ©пЉИHRпЉЙ¬†дЉЉдєОжШѓйА†жИРињЩзІНеЈЃеЉВзЪДеФѓдЄАеОЯеЫ†пЉМеЫ†дЄЇеЬ®ж†ЗеЗЖй£ОйЩ©пЉИSRпЉЙз†Фз©ґAALL0331дЄ≠пЉМIgHеЇПеИЧдЄОжВ£иАЕзЪДйҐДеРОжЧ†еЕ≥пЉИеЫЊ1AпЉЙгАВ
 
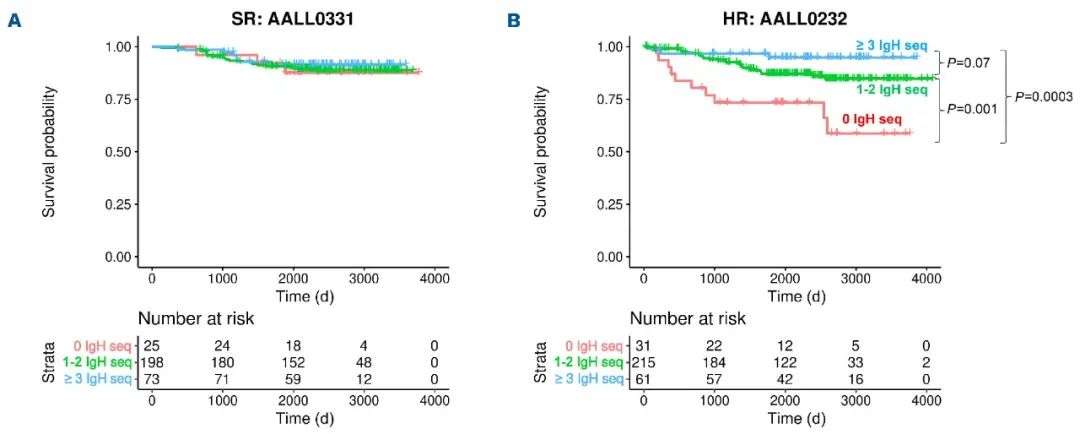
еЫЊ1¬†IgHзїДжИРеѓєзФЯе≠ШзЪДељ±еУН
 
IgHеЇПеИЧељ±еУНHR¬†B-ALLжВ£иАЕзЪДEFSпЉМељУIgHжШЊиСЧжАІеЕЛйЪЖеЇПеИЧвЙ•3жЧґпЉМжВ£иАЕзЪД5еєіEFSжШОжШЊдЉШдЇОIgH жШЊиСЧжАІеЕЛйЪЖеЇПеИЧ<3зЪДжВ£иАЕпЉИеЫЊ1BпЉЙпЉЫIgHеЇПеИЧеѓєSR B-ALLжВ£иАЕзЪД5еєіEFSеИЩж≤°жЬЙжШОжШЊељ±еУНпЉИеЫЊ1AпЉЙгАВ
 
дљЬиАЕињШеПСзО∞пЉМIgHзїДжИРдїЕеЬ®ж≤°жЬЙжЬЙеИ©зЪДзїЖиГЮйБЧдЉ†е≠¶зЪДжГЕеЖµдЄЛйҐДжµЛзїУжЮЬгАВдї•жШЊиСЧжАІеЕЛйЪЖеЇПеИЧдЄЇеПВиАГпЉМдЇЪеЕЛйЪЖ襀еЃЪдєЙдЄЇDеТМJеЯЇеЫ†дЄОжШЊиСЧжАІеЕЛйЪЖеЇПеИЧзЫЄеРМзЪДеЇПеИЧпЉМD-JињЮжО•е§ДжЬЙ>2дЄ™’N’祱еЯЇпЉМдї•еПКдЄНеРМзЪДVеЯЇеЫ†гАВжЬЙдЇЪеЕЛйЪЖжЉФеПШзЪДжВ£иАЕеТМжЧ†дЇЪеЕЛйЪЖжЉФеПШзЪДжВ£иАЕзЪДзїЖиГЮйБЧдЉ†е≠¶еЕЈжЬЙеЈЃеЉВжАІгАВеЬ®31дЊЛпЉИ7.2%пЉЙзЉЇдєПV-DJдЇЪеЕЛйЪЖжЉФеПШзЪДжВ£иАЕдЄ≠пЉМж≤°жЬЙдЄАдЊЛжЬЙиЙѓе•љзЪДETV6-RUNX1иЮНеРИгАВдЄОDTеТМеЕґдїЦдЄНиЙѓзїЖиГЮйБЧдЉ†жВ£иАЕзЫЄжѓФпЉМETV6-RUNX1иЮНеРИжВ£иАЕзЪДV-DJдЇЪеЕЛйЪЖе§Ъж†ЈжАІжЫіе§ІпЉИеЫЊ2AпЉЙгАВзДґиАМпЉМдЇЪеЕЛйЪЖе§Ъж†ЈжАІзЪДз®ЛеЇ¶еєґдЄНељ±еУН5еєізЪДEFSпЉИеЫЊ2BпЉЙгАВ
 
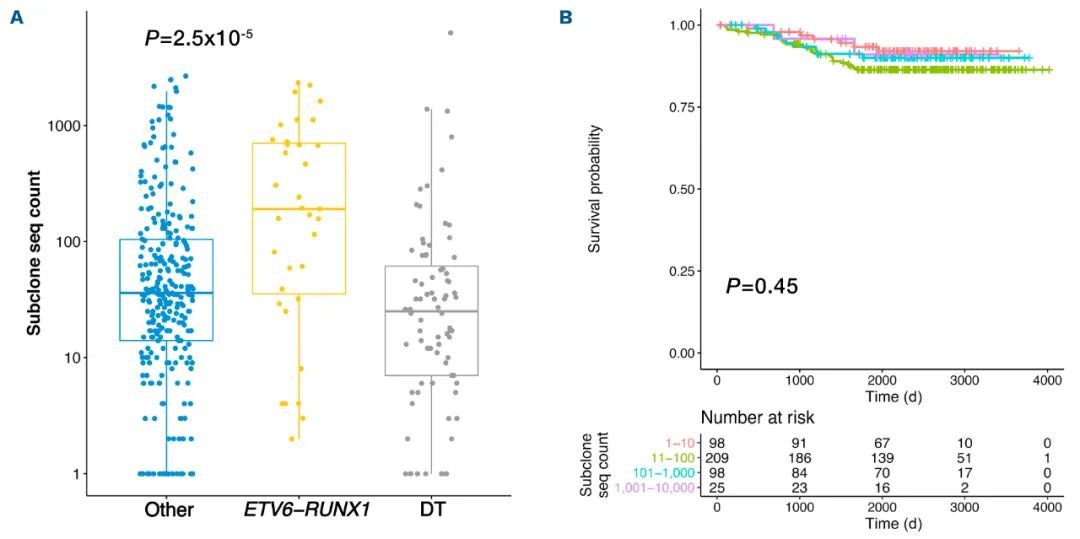
еЫЊ2¬†V-DJдЇЪеЕЛйЪЖзЪДе§Ъж†ЈжАІ
з†Фз©ґзїУжЮЬжШЊз§ЇпЉМдЄОдљњзФ®HTS MRDйҐДжµЛе§НеПСдЄНеРМпЉМж≤їзЦЧеЙНIgH HTSжХ∞жНЃеПѓиГљжПРдЊЫзЛђзЂЛзЪДйҐДеРОдњ°жБѓгАВиѓКжЦ≠жЧґеПѓж£АжµЛеИ∞зЪДIgHжШЊиСЧжАІеЕЛйЪЖеЇПеИЧзЪДжХ∞йЗПдЄОйВ£дЇЫзЉЇдєПиЙѓе•љзїЖиГЮйБЧдЉ†зЪДHRзЩљи°АзЧЕжВ£иАЕзЪДйҐДеРОзЫЄеЕ≥пЉМж≤°жЬЙIgHжШЊиСЧжАІеЕЛйЪЖеЇПеИЧзЪДжВ£иАЕйҐДеРОе∞§еЕґеЈЃгАВ
ETV6-RUNX1зЩљи°АзЧЕйАЪеЄЄеП™жШЊз§Ї1-2дЄ™жШЊиСЧжАІзЪДгАБеЃМеЕ®йЗНзїДзЪДV-DJеЇПеИЧгАВдЄОеЕґдїЦзїЖиГЮйБЧдЉ†зїДзЫЄжѓФпЉМDTжВ£иАЕжЬЙвЙ•3дЄ™IgHжШЊиСЧжАІеЕЛйЪЖеЇПеИЧзЪДжѓФдЊЛжЫійЂШпЉМиЩљзДґињЩдЄАеПСзО∞еПѓиГљдЉЪеЉХиµЈеЕ≥дЇОиЙѓе•љзїЖиГЮйБЧдЉ†еѓєйҐДеРОзЪДжЈЈжЭВжХИеЇФзЪДеЕ≥ж≥®пЉМдљЖдїЕеЬ®AALL0331йШЯеИЧдЄ≠жШЊиСЧпЉМеЬ®IgHзїДдєЛйЧіж≤°жЬЙиІВеѓЯеИ∞зФЯе≠ШеЈЃеЉВгАВ
IgHзїДжИРеѓєйҐДеРОзЪДељ±еУНдїЕйЩРдЇОзЉЇдєПиЙѓе•љзїЖиГЮйБЧдЉ†зЪДжВ£иАЕпЉМињЩи°®жШОзїЖиГЮйБЧдЉ†е≠¶дЄНиГљеНХзЛђиІ£йЗКиІВеѓЯеИ∞зЪДзФЯе≠Шељ±еУНгАВзЫЄеПНпЉМеЕґдїЦзЙєеЊБвАФвАФе¶ВзЩљи°АзЧЕиљђеМЦжЧґзЪДbзїЖиГЮйШґжЃµвАФвАФеПѓиГљжШѓIgHзїДжИРеТМйҐДеРОдєЛйЧіеЕ≥з≥їзЪДеЯЇз°АгАВ
еЬ®B-ALLдЄ≠пЉМдЇЪеЕЛйЪЖжЉФеПШзЪДжДПдєЙдїНжЬЙеЊЕжШОз°ЃгАВIgHйУЊзЪДвАЬжЬЙеЇПйЗНжОТвАЭжґЙеПКеИ∞дЄАдЄ™еИЭеІЛзЪДD-JињЮжО•пЉМзДґеРОеТМVеЯЇеЫ†зїІзї≠йЗНжОТпЉМеѓЉиЗідЇЪеЕЛйЪЖеЇПеИЧиГље§ЯдїОдЄАдЄ™еЕ±еРМзЪДDJйЗНзїДеЙНдљУдЄ≠и°НзФЯеЗЇжЭ•гАВеЬ®жЬђз†Фз©ґдЄ≠пЉМ92.8%зЪДзЧЕдЊЛжЬЙдЇЪеЕЛйЪЖIgHеЇПеИЧпЉМ25дЊЛпЉИ5.8%пЉЙзЪДдЇЪеЕЛйЪЖIgHеЇПеИЧ>1000гАВз†Фз©ґзїУжЮЬиѓБеЃЮдЇЖV-DJдЇЪеЕЛйЪЖињЫеМЦеЬ®B-ALLдЄ≠жЩЃйБНе≠ШеЬ®пЉМеПѓиГљеЬ®ETV6-RUNX1иЮНеРИзЪДжВ£иАЕдЄ≠и°®зО∞жЬАе§ІпЉМдљЖжХ∞жНЃж≤°жЬЙжШЊз§ЇињЩзІНзО∞и±°еѓєйҐДеРОзЪДдїїдљХељ±еУНгАВ
ж≤їзЦЧеЙНIgHзїДжИРеПѓиГљжПРдЊЫдЄАдЄ™жЬЇдЉЪжЭ•зїЖеМЦB-ALLзЪДеН±йЩ©еИЖе±ВпЉМзЙєеИЂжШѓеЬ®йАЙеЃЪзЪДHRзЦЊзЧЕжВ£иАЕдЄ≠пЉМйАЪињЗжПРдЊЫдњ°жБѓпЉМжПРйЂШељУеЙНй£ОйЩ©еИЖе±ВзЪДиГљеКЫпЉМдї•йҐДжµЛеУ™дЇЫжВ£иАЕж≥®еЃЪдЉЪе§НеПСгАВиѓЖеИЂжЫіеОЯеІЛзЪДзїЖиГЮзЊ§еРМж†ЈеПѓиГљдЇІзФЯжЦ∞зЪДж≤їзЦЧйАЙжЛ©дї•жФєеЦДзїУжЮЬгАВ
 


 


