
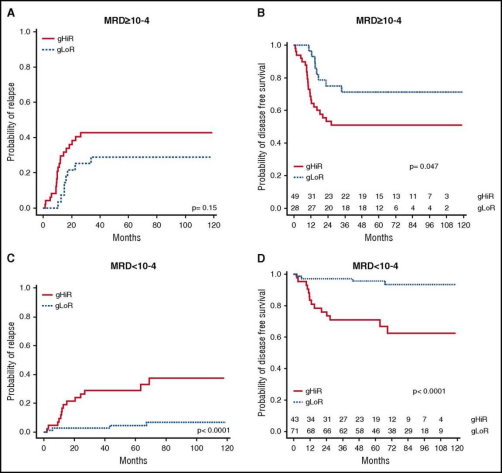
注:gLoR癌基因低风险,gHiR癌基因高风险,MRD结果以10-4为cutoff。
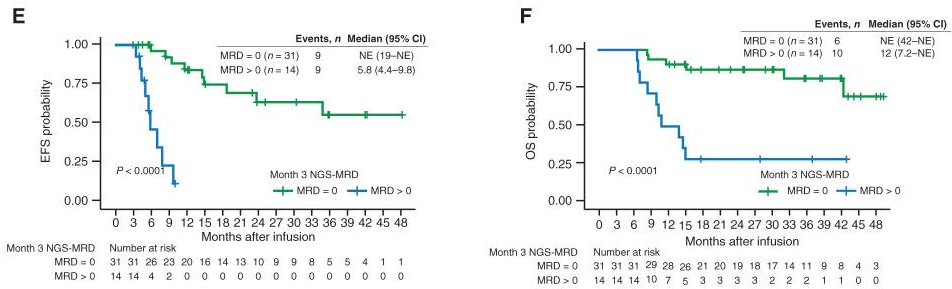
注:CAR-T治疗后3个月MRD>0与MRD=0患者EFS和OS的比较。
| 检测方法 | 原理 | 灵敏度 | 优点 | 缺点 |
| MFC | 通过流式细胞术鉴定癌细胞,分析癌细胞表面特异性抗原 | 10-4 | a.快速,相对便宜,广泛适用和可及
b.可发现表型漂移 c.可不需要治疗前样本 |
a.需要使用新鲜样本,在24-48h内评估
b.依赖实验员主观经验,需要经验丰富的流式细胞术专家 c.缺乏标准化 |
| NGF | 通过检测细胞表面标记物表达,鉴别正常和异常浆细胞 | 10-5 | a.在MFC基础上的优化,灵敏度提升,高度自动化
b.基于大量细胞的分析 |
a.需要使用新鲜样本
b.无法检测克隆进化 c.数据分析复杂 |
| ASO-PCR | 通过特异性PCR扩增目标DNA序列,检测PCR产物中是否存在单核苷酸多态性 | 10-5 | a.广泛适用
b.完全标准化的检测方法和数据标准 c.灵敏度高 |
a.需要为患者特异性设计引物,耗时耗力且昂贵
b.需要治疗前样本 c.初诊时可能不能发现小克隆 d.不能追踪克隆演变 |
| NGS | 使用高通量测序检测克隆VDJ基因重组 | 10-6 | a.灵敏度高
b.可使用新鲜或冻存的样本 c.可以追踪微小克隆,发现克隆演变 |
a.需要治疗前样本
b.相对流式来说,检测周期偏长,价格偏贵 |
| PET-CT | 通过在人体内注射少量的放射性药物,并使用放射性探测器进行检测,可检出显示代谢活性及形态学的病变损害 | 空间分辨率限制约为5mm | a.检测髓外病变有优势,可以准确定位骨和髓外病变部位 | a.检查结果基于形态学改变,不能及时发现分子层面的复发
b.有核辐射 |
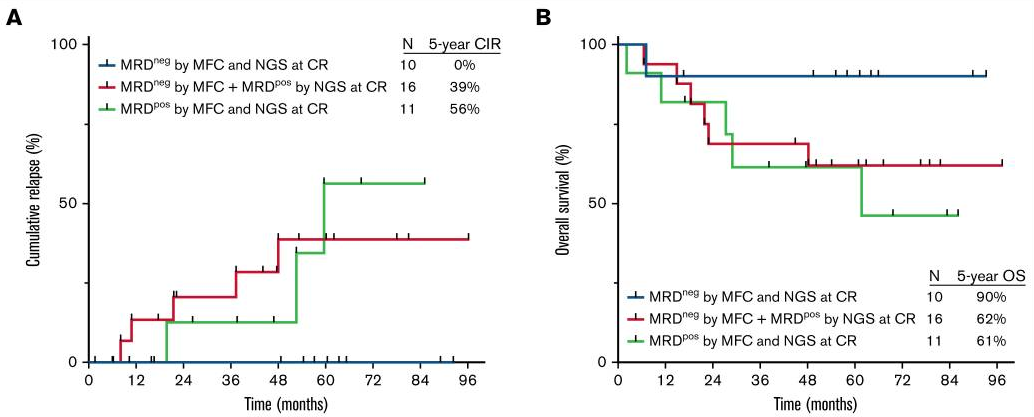
注:NGS和MFC两种MRD检测方法与5年累计复发率(图A)和5年总生存率(图B)相关性的比较。
这不同于基因突变检测等其它基因测序,基因突变检测是分析DNA构象或解链特性,或者利用DNA变性和复性等特性,进行DNA突变的分析,也就是通过一些基因突变信息来鉴定癌细胞。而NGS MRD是基于测到的可变区序列( 克隆)频率高低来鉴定癌细胞,两者检测原理不同。即便癌细胞DNA发生了突变,TCR/BCR通常是稳定不变的,依然可以进行追踪。
gDNA与ctDNA的选择
国内外指南推荐
《NCCN急性淋巴细胞白血病临床实践指南》2022年版
《NCCN多发性骨髓瘤临床实践指南》2022年版
《NCCN儿童急性淋巴细胞白血病临床实践指南》 2023年版
《医疗机构医院儿童急性淋巴细胞白血病诊疗规范》 2020年版
《中国成人急性淋巴细胞白血病诊断与治疗指南》 2021年版
《中国多发性骨髓瘤诊治指南》 2022年版



每种B/T淋巴细胞表面均存在一种特异性B细胞受体 B cell receptor,BCR/la)T细胞受体 (T cell receptor,TCR),由于BCR/TCR因中V、D、J基因片段重组与碱基的随机插入、删减,导致BCR/TCR具有高度多样性的特点,从而BCR/TCR可作为每个BT淋巴细胞唯一的分子标签。
淋系血液癌症患者因B/T淋巴细胞发生癌变,癌细胞继而自我复制形成克隆性增殖,因此,通过检测B/T淋巴细胞表面受体BCR/TCR可以鉴定癌细胞并追踪检测癌细胞的动态变化。

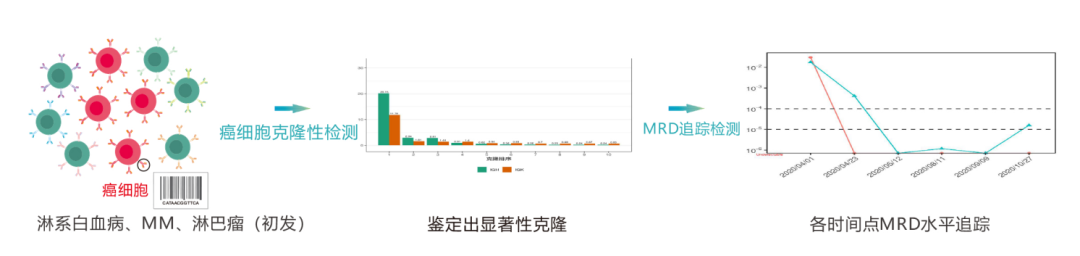
1.癌细胞克隆性检测
通过患者初诊或癌细胞高负荷时的骨髓样本,找到癌细胞特有的DNA“标签”序列。
2.MRD追踪检测
利用筛查出的DNA“标签”序列,在治疗期间或治疗后评估MRD水平,监测癌细胞含量,同时检测识别新出现的癌细胞序列。

1. B系血液系统癌症
急性/慢性B淋巴细胞白血病、多发性骨髓瘤、B型淋巴瘤。
2. T系血液系统癌症
急性/慢性T淋巴细胞白血病、T型淋巴瘤。

Seq-MRD®能提供高精度、高灵敏度的MRD检测解决方案,可帮助医生更准确地评估癌症患者的治疗反应和预后。这些技术在现代肿瘤治疗中扮演着越来越重要的角色,因为它们能够帮助医生识别那些患病复发风险高的患者,并为他们提供更个性化、更有针对性的治疗方案。



Seq-MRD®获得欧盟CE资质(注册号:DE/CA20/01-IVD-Luxuslebenswelt-190/22),获批的是人淋巴B细胞微小残留病基因检测试剂盒(可逆末端终止测序法)。


艾沐蒽推出的Seq-MRD®血液癌症MRD检测是最早批实现商业化的产品,自2016年研发专利技术至今,艾沐蒽Seq-MRD®已经获得3项国家发明专利:
[1]“一种应用于高通量测序检测T细胞白血病微小残留病的引物组合及试剂盒”(专 利 号: 2016 11204857.0,授权公告号:CN 106957906 B)
[2]“一种检测微小残留病MRD的试剂盒”(专 利 号: 2018 1 1550133.0,授权公告号: CN 109652518 B)
[3]“一种检测微小残留病MRD的方法”(专 利 号: 2018 1 1549203.0,授权公告号: CN 109680062 B)


Seq-MRD®发表相关文献
Huang Y, Zhao H, Shao M, Zhou L, Li X, Wei G, Wu W, Cui J, Chang AH, Sun T, Hu Y, Huang H. Predictive value of next-generation sequencing-based minimal residual disease after CAR-T cell therapy. Bone Marrow Transplant. 2022 Jun 1. doi: 10.1038/s41409-022-01699-2. Epub ahead of print. PMID: 35650329.(点击链接可查看文章内容)



[2]国家卫健委. 淋巴瘤诊疗指南(2022年版).
[3] Michael A. Pulsipher, Xia Han, Shannon L. Maude, et al. next generation sequencing of minimal residual disease for predicting relapse after tisagenlecleucel in children and young adults with acute lymphoblastic leukemia .Blood Cancer Discov. 2022 Jan; 3(1): 66–81.
[4]Short NJ, Kantarjian H, Ravandi F,et al. High-sensitivity next-generation sequencing MRD assessment in ALL identifies patients at very low risk of relapse. Blood Adv. 2022 Jul 12;6(13):4006-4014.

杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。
艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。


