文献分享
题目:外周血T细胞受体多样性是乳腺癌进展的年龄相关标志物
发表期刊:PNAS
发表时间:2023年11月27日
影响因子:9.4
研究结果外周血TCR克隆型多样性在乳腺癌中的表现
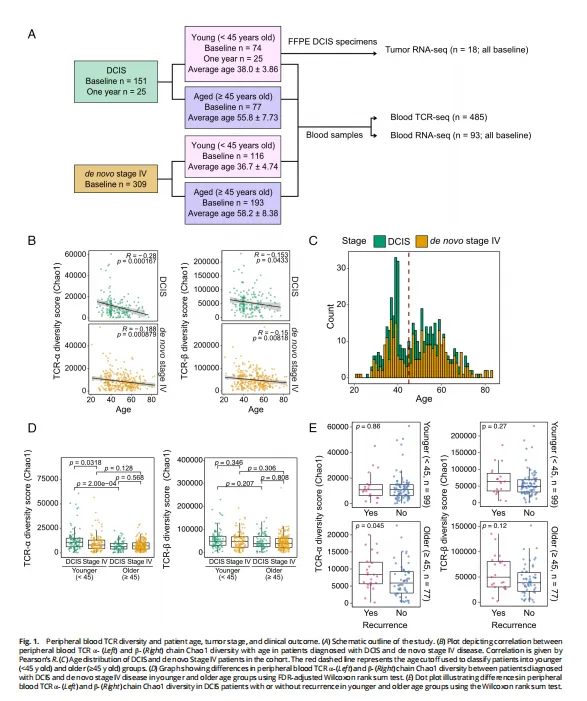
本研究通过对外周血T细胞受体(TCR)的α和β链进行测序,评估了485名乳腺癌患者的TCR克隆型多样性。这些患者涵盖了广泛的年龄范围(平均年龄48岁,范围21至83岁),并被诊断为导管原位癌(DCIS)或初诊IV期乳腺癌(图1A)。研究选择了这两个阶段的患者,因为它们分别代表了乳腺癌的最早和最晚期阶段,有助于识别与肿瘤阶段相关的差异,而不受治疗影响。所有初诊IV期患者(n = 309)和大多数DCIS患者(151/176)的血液样本在诊断时采集,而25名DCIS患者在手术切除后一年再次采集了血液样本。
研究使用了多种多样性指标来评估TCR克隆型的分布情况,包括丰富度、Chao1指数、Shannon指数以及Shannon和Simpson克隆性指数。这些指标从不同角度评估了TCR克隆型分布的生物特性,如数量及其相对丰度。通过对这些多样性的全面评估,研究者能够更深入地理解乳腺癌患者的免疫状态,并为进一步的研究提供了基础。
对于6名DCIS患者,研究者分析了基线和一年后的匹配样本,结果显示在这段时间内,无论是TCR-α还是TCR-β链的六种多样性指数都没有显著变化。这一结果表明,手术切除DCIS可能不会对TCR克隆型多样性产生长期影响,尽管样本量较小,结论需谨慎。
随着年龄的增长,TCR-α和TCR-β的Chao1多样性(未观察到的总丰富度)逐渐减少,而克隆性(Shannon和Simpson指数)则增加(图1B)。这种趋势在DCIS和初诊IV期患者中均有所体现,且TCR-α的多样性与年龄的相关性尤为显著。为了更细致地分析不同年龄段的差异,研究将患者分为年轻组(<45岁)和老年组(≥45岁)。选择45岁作为分界线的原因在于,它能够将患者分为可能处于绝经前(年轻DCIS患者的平均年龄为38.0 ± 3.86岁,初诊IV期患者的平均年龄为36.7 ± 4.74岁)和绝经后(年长DCIS患者的平均年龄为55.8 ± 7.73岁,初诊IV期患者的平均年龄为58.2 ± 8.38岁)的两组。此外,研究发现患者的年龄分布呈现二项式分布(图1C)。
为了探究不同乳腺癌阶段和年龄段患者的T细胞受体(TCR)多样性差异,研究特别关注了Chao1指数,这一指标被认为能更可靠地评估TCR,因为它与年龄有显著的相关性。年轻DCIS患者的TCR-α Chao1多样性显著高于年轻的初诊IV期患者或年长的DCIS患者(图1D)。相比之下,在老年患者中,DCIS与初诊IV期之间的TCR-α多样性没有显著差异,提示肿瘤阶段对TCR多样性的影响在老年患者中不明显(图1D)。此外,TCR-β多样性和其他指标在不同类别之间无显著差异(图1D)。
研究发现,老年DCIS患者中,那些经历后续癌症诊断的患者(包括同侧或对侧乳腺癌、胸壁或远处复发)的TCR-α Chao1多样性显著高于未复发的患者(图1E)。相反,在年轻DCIS患者中,复发与TCR多样性无关,可能由于双侧乳房切除术的高频率掩盖了这一关联(图1E)。此外,研究通过多变量Cox回归分析评估了TCR多样性与总体生存率的关系,但未发现显著关联。
总的来说,研究发现了TCR-α Chao1多样性与DCIS和初诊IV期疾病患者的年龄以及年轻女性的肿瘤分期相关,并且与老年DCIS患者后续癌症诊断的风险有关。
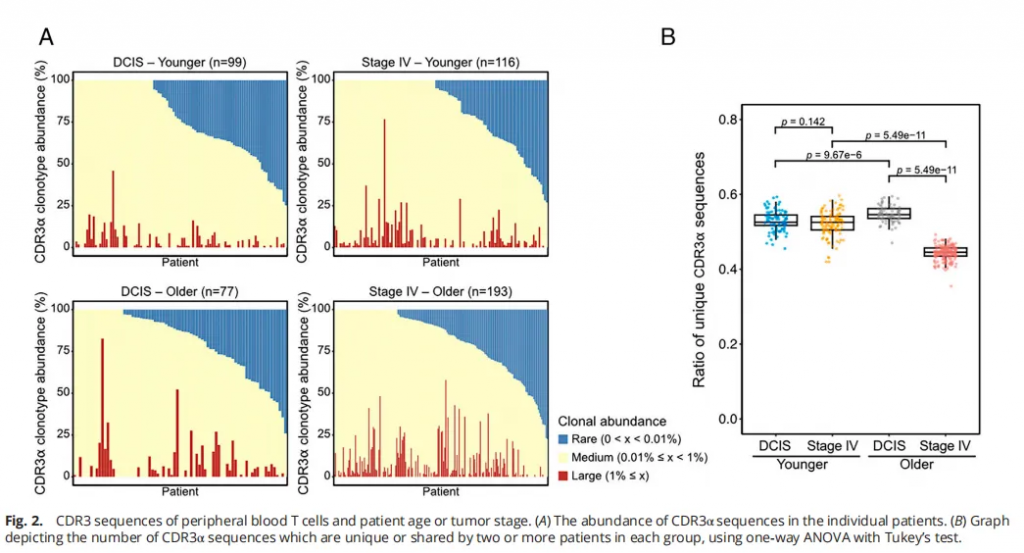
患者独特的外周T细胞CDR3序列
研究发现年长的初诊IV期患者CDR3α序列比例(即独特序列数除以总序列数)显著低于其他组别(图2B)。在氨基酸水平上相似的CDR3α序列可能识别相同的抗原,所以为了进一步探索这些序列的功能,研究者使用Geometric Isometry-based TCR AligNment Algorithm (GIANA)工具对所有患者的CDR3α序列进行了聚类分析。结果显示,年轻DCIS患者拥有更多的CDR3α簇,这意味着他们可能具有更多针对不同抗原的T细胞克隆型。这与所观察到的TCR-α Chao1多样性的差异相一致。相比之下,年长的DCIS和初诊IV期患者的CDR3α序列聚类相似。
此外,研究还发现,年轻DCIS患者中,无复发者的独特CDR3α簇数量多于有复发者,而在老年患者中未观察到这种差异。预测的抗原类型也因复发状态而异,尤其是在年轻DCIS患者中,提示TCR多样性可能与临床结果密切相关。然而,这些关联需要进一步的实验验证,以确保预测的准确性和完整性。总之,CDR3α序列的多样性不仅反映了患者的免疫状态,还可能与临床结果密切相关,特别是在年轻DCIS患者中。
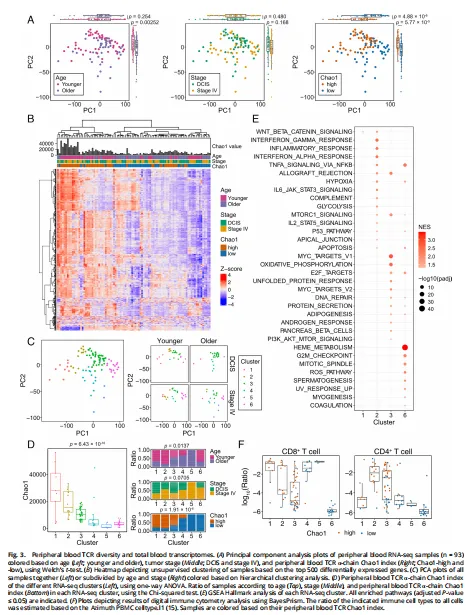
外周血TCR多样性与外周血转录组的关系
通过对外周血样本进行RNA测序,研究发现TCR-α Chao1多样性与基因表达模式之间存在强关联。高TCR多样性患者的外周血转录组表现出与先天免疫反应、翻译、转录、线粒体功能和细胞周期等通路的富集。相反,低TCR多样性患者的转录组则与增殖和代谢特征相关。通过细胞组成分析,研究发现高TCR多样性患者的样本中单核细胞比例较高,解释了其强烈的炎症反应特征。聚类分析显示,TCR多样性比肿瘤阶段或年龄更能区分样本。
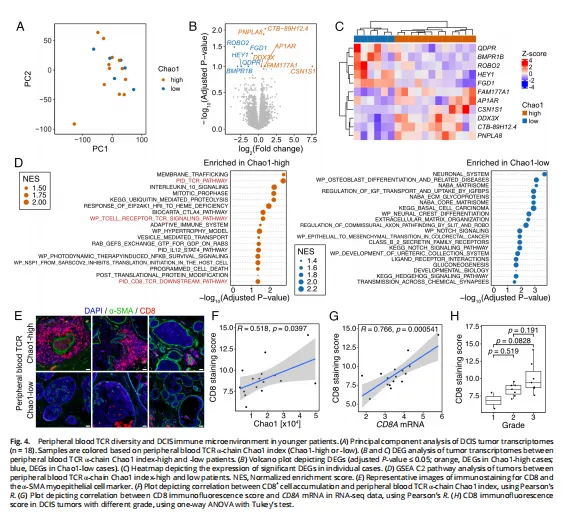
外周血TCR多样性与DCIS免疫微环境的关系
最后,研究探讨了外周血TCR多样性与DCIS肿瘤转录组之间的关系。尽管在外周血TCR-α Chao1多样性与肿瘤分级之间未发现显著关联,但在高TCR多样性患者的DCIS肿瘤中,发现了与适应性免疫系统和TCR信号通路相关的基因表达富集。此外,免疫荧光染色显示,高TCR多样性患者的DCIS肿瘤中CD8+ T细胞含量较高,且CD8+ T细胞的丰度与外周血TCR-α Chao1多样性呈正相关。这些结果表明,高TCR多样性可能与更活跃的免疫微环境有关,特别是在预侵袭性肿瘤中。
研究讨论
该研究表明,外周血TCR多样性不仅是年龄的反映,还可能是预测乳腺癌进展的有用生物标志物,尤其是在不同年龄段的患者中。高TCR多样性可能反映了更强的抗肿瘤免疫反应,但也可能与肿瘤支持性免疫的存在有关。未来的研究需要更大的队列来验证这些发现,并探索特定TCR序列对预后的影响。此外,评估不同T细胞亚群(如CD4+、CD8+和调节性T细胞)的多样性将有助于进一步理解其在肿瘤进展中的作用。
