
ABSTRACT
иГМжЩѓпЉЪеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВ(ICIs)еЈ≤зїПељїеЇХжФєеПШдЇЖзЩМзЧЗж≤їзЦЧгАВзДґиАМпЉМеЃГдїђдЄОдЄАз≥їеИЧзЛђзЙєзЪДеЙѓдљЬзФ®жЬЙеЕ≥пЉМзІ∞дЄЇеЕНзЦЂзЫЄеЕ≥дЄНиЙѓдЇЛдїґ(irAEs)пЉМе¶ВжЮЬдЄНеПКжЧґж≤їзЦЧпЉМеПѓеЉХиµЈдЄ•йЗНзЪДеПСзЧЕзОЗпЉМеєґињЕйАЯеПСе±ХдЄЇдЄ•йЗНжИЦеН±еПКзФЯеСљзЪДдЇЛдїґгАВеЫ†ж≠§пЉМеЬ®еЕНзЦЂж≤їзЦЧеЉАеІЛдєЛеЙНз°ЃеЃЪirAEsзЪДйҐДжµЛжАІзФЯзЙ©ж†ЗењЧзЙ©жШѓдЄАдЄ™еЕ≥йФЃзЪДз†Фз©ґйҐЖеЯЯгАВTзїЖиГЮеПЧдљУ-(TCRB)еПШйЗП(TRBV)еЯЇеЫ†зЪДе§ЪжАБжАІдЄОиЗ™иЇЂеЕНзЦЂжАІзЦЊзЧЕжЬЙеЕ≥пЉМеєґеПѓиГљдЄОirAEsжЬЙжЬЇеИґиБФз≥їгАВзДґиАМпЉМTCRBдљНзВєзЪДйЗНе§НжАІиі®еТМдЄНеЃМжХізЪДеЯЇеЫ†зїДзїДи£ЕињЗеОїйШїзҐНдЇЖTRBVе§ЪжАБжАІзЪДиѓДдЉ∞гАВ
жВ£иАЕеПКжЦєж≥ХпЉЪдљЬиАЕдљњзФ®дЇЖдЄАзІНжЦ∞зЪДжЦєж≥ХпЉМеѓєжЭ•иЗ™е§ЦеС®и°АжАїRNAзЪДйЗНжОТTCRBйУЊињЫи°МйХњжЙ©еҐЮе≠РдЄЛдЄАдї£жµЛеЇПпЉМдї•иѓДдЉ∞жО•еПЧеЕНзЦЂж≤їзЦЧзЪДзЩМзЧЗжВ£иАЕдЄ≠TRBVе§ЪжАБжАІдЄОirAEsдєЛйЧізЪДиБФз≥їгАВйАЪињЗдљњзФ®е§ЪйЗНPCRеИЫеїЇдЇЖиЈ®иґКдЄЙдЄ™ќ≤йУЊдЇТи°•еЖ≥еЃЪеМЇ(CDR)еМЇеЯЯзЪДжЙ©еҐЮе≠РпЉМйЩ§дЇЖCDR3еИЖжЮРе§ЦпЉМињШеПѓдї•ж£АжµЛзІНз≥їзЉЦз†Бж°ЖжЮґеТМCDR1еТМCDR2еМЇеЯЯзЪДе§ЪжАБжАІгАВжЙАеЊЧеИ∞зЪДжЙ©еҐЮе≠РйАЪињЗIon TorrentжµЛеЇПпЉМдЄЇжѓПдЄ™дЄ™дљУжЮДеїЇзЪДTRBVз≠ЙдљНеЯЇеЫ†еЫЊи∞±дЄОirAEж≥®йЗКзЫЄеЕ≥пЉМдї•з°ЃеЃЪдЄОдЄ•йЗНirAE(вЙ•3зЇІ)зЫЄеЕ≥зЪДеНХеАНеЮЛгАВ
зїУжЮЬпЉЪз†Фз©ґзЇ≥еЕ•дЇЖ81дЊЛеЬ®жО•еПЧзЩМзЧЗеЕНзЦЂж≤їзЦЧжЧґеПСзФЯirAEsзЪДжВ£иАЕгАВйАЪињЗеѓє81дЄ™TRBVз≠ЙдљНеЯЇеЫ†зЪДдЄїжИРеИЖеИЖжЮРеТМk-meansиБЪз±їпЉМйЙіеЃЪеЗЇдЇЖ6дЄ™дЄїи¶БзЪДTRBVеНХеАНеЮЛгАВеПСзО∞иѓ•йШЯеИЧдЄ≠жЬЙдЄЙеИЖдєЛдЄАзЪДдЇЇеЕЈжЬЙTRBVз≠ЙдљНеЯЇеЫ†еНХеАНеЮЛпЉМдЉЉдєОеПѓдї•йҐДйШ≤дЄ•йЗНзЪДirAEsгАВ
зїУиЃЇпЉЪињЩдЇЫжХ∞жНЃи°®жШОпЉМйХњжЙ©еҐЮе≠РTCRBеЕ®еЇУжµЛеЇПеПѓдї•жљЬеЬ®еЬ∞иѓЖеИЂдЄОдЄ•йЗНirAEsй£ОйЩ©зЫЄеЕ≥зЪДTRBVеНХеАНеЮЛзїДгАВзІНз≥їзЉЦз†БTRBVе§ЪжАБжАІеПѓдљЬдЄЇдЄ•йЗНirAEsзЪДйҐДжµЛжАІзФЯзЙ©ж†ЗењЧзЙ©гАВ
01 з†Фз©ґиГМжЩѓ
еЕНзЦЂж£АжЯ•зВєжКСеИґеЙВ(ICIs)йАЪињЗйАЖиљђиВњзШ§иѓ±еѓЉзЪДеЕНзЦЂз≥їзїЯжКСеИґпЉМдїОиАМйЗКжФЊеЉЇе§ІзЪДзїЖиГЮжѓТжАІTзїЖиГЮдїЛеѓЉзЪДжКЧиВњзШ§еПНеЇФпЉМеЬ®зЩМзЧЗж≤їзЦЧдЄ≠еИЫйА†дЇЖдЄАдЄ™иМГеЉПиљђеПШгАВдїЛеѓЉжМБдєЕжЧ†ињЫе±ХзФЯе≠ШзЪДTзїЖиГЮеПНеЇФдєЯеПѓиГљдњГињЫTзїЖиГЮеѓєдЄАдЇЫжВ£иАЕеБ•еЇЈзїДзїЗзЪДз†іеЭПпЉМдїОиАМдЇІзФЯдЄАз≥їеИЧзЛђзЙєзЪДеЙѓдљЬзФ®пЉМзІ∞дЄЇеЕНзЦЂзЫЄеЕ≥дЄНиЙѓдЇЛдїґ(irAEs)гАВињЩдЇЫirAEsеПѓељ±еУНе§ЪдЄ™еЩ®еЃШпЉМе¶ВжЮЬдЄНеПКжЧґж≤їзЦЧпЉМеПѓиГљдЉЪињЕйАЯжБґеМЦпЉМеѓЉиЗідЄ•йЗНзЪДеПСзЧЕзОЗгАБж∞ЄдєЕжАІжНЯдЉ§пЉМзФЪиЗ≥ж≠їдЇ°гАВе∞љзЃ°еЬ®иЊЕеК©ж≤їзЦЧдЄ≠дљњзФ®ICIеЕЈжЬЙдЄАиЗізЪДжЧ†е§НеПСзФЯе≠Ш(RFS)зЫКе§ДпЉМдљЖдЄОICIж≤їзЦЧзЫЄеЕ≥зЪДirAEsзЪДеПСзЧЕзОЗеТМеПСзЧЕзОЗжШѓжШЊиСЧзЪДпЉМињЩи°®жШОињЂеИЗйЬАи¶БиѓЖеИЂдЄ•йЗНirAEs(вЙ•3зЇІ)й£ОйЩ©зЪДжВ£иАЕгАВ
ж≠§е§ЦпЉМеЬ®жЦ∞иЊЕеК©иНѓзЙ©еТМиЊЕеК©иНѓзЙ©дљњзФ®жЙ©е§ІзЪДиґЛеКњзЪДжО®еК®дЄЛпЉМйЪПзЭАжО®иНРдљњзФ®ICIsзЪДзЩМзЧЗйАВеЇФзЧЗзЪДжХ∞йЗПжМБзї≠еҐЮйХњпЉМICIsзЪДеМїзЦЧиіЯжЛЕдєЯе∞ЖжИРжѓФдЊЛеЬ∞еҐЮеК†гАВйЙідЇОirAEsзЪДжЬЙжХИзЃ°зРЖдЊЭиµЦдЇОжЧ©жЬЯиѓЖеИЂеТМеПКжЧґеє≤йҐДпЉМеЫ†ж≠§ињЂеИЗйЬАи¶БиѓЖеИЂжЬЙдЄ•йЗНirAEsй£ОйЩ©зЪДжВ£иАЕгАВзДґиАМпЉМеИ∞зЫЃеЙНдЄЇж≠ҐпЉМињШзЉЇдєПеПѓйЭ†зЪДзФЯзЙ©ж†ЗењЧзЙ©жЭ•йҐДжµЛйЂШеН±жВ£иАЕгАВ
дЄЇдЇЖеЕЛжЬНWGSж£АжµЛTRBVе§ЪжАБжАІзЪДжМСжИШпЉМдљЬиАЕеЉАеПСдЇЖдЄАзІНйАЪињЗе§ЦеС®и°АзЩљзїЖиГЮйЗНжОТTCRBйУЊзЪДдЄЛдЄАдї£жµЛеЇП(NGS)ж£АжµЛTRBVе§ЪжАБжАІзЪДжЦєж≥ХгАВињЩдї£и°®дЇЖзђђдЄАдЄ™еЯЇдЇОNGSзЪДжЦєж≥ХпЉМеЕБиЃЄTRBдљНзВєзЪДеНХеАНеЮЛж∞іеє≥еИЖиЊ®зОЗгАВеЬ®ињЩй°єз†Фз©ґдЄ≠пЉМйАЪињЗиѓДдЉ∞TRBVе§ЪжАБжАІдЄОдЄ•йЗНirAEsдєЛйЧізЪДиБФз≥їпЉМдљњзФ®дїО81еРНеЬ®ICIж≤їзЦЧжЬЯйЧізїПеОЖдЄНеРМдЄ•йЗНз®ЛеЇ¶irAEsзЪДдЄ™дљУдЄ≠жФґйЫЖзЪДе§ЦеС®и°Аж†ЈжЬђгАВ
02 з†Фз©ґжЦєж≥Х
1.йШЯеИЧйАЙжЛ©еТМжППињ∞
жФґйЫЖ81дЊЛеЬ®иВњзШ§еЕНзЦЂж≤їзЦЧињЗз®ЛдЄ≠еЗЇзО∞дЄНеРМз®ЛеЇ¶irAEsзЪДзЩљдЇЇжВ£иАЕе§ЦеС®и°Аж†ЈжЬђгАВ
2.жЦЗеЇУеИґе§ЗеПКжµЛеЇП
жПРеПЦRNAеРОињЫи°МйАЖиљђељХиОЈеЊЧcDNAпЉМйАЪињЗе§ЪйЗНPCRиОЈеЊЧи¶ЖзЫЦTCRќ≤дЄЙдЄ™дЇТи°•еЖ≥еЃЪеМЇ(CDR)зЪДзЇ¶330bpйХњжЙ©еҐЮе≠РеєґжµЛеЇПпЉМжѓПдЄ™жЦЗеЇУиЊЊеИ∞зЇ¶150дЄЗжђ°еОЯеІЛиѓїеПЦгАВ
3.81дЊЛжВ£иАЕж†ЈжЬђеНХеАНеЮЛзЊ§йЙіеЃЪ
4.еЕНзЦЂзЫЄеЕ≥дЄНиЙѓдЇЛдїґзЪДйҐДжµЛ
03 зїУжЮЬ
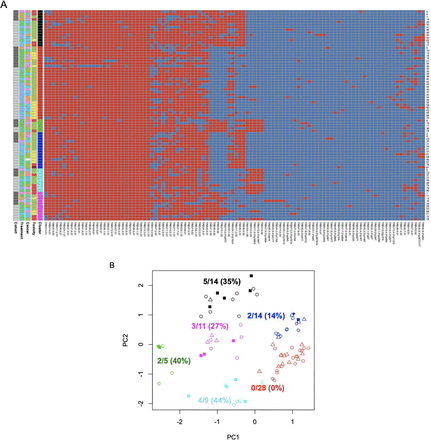
TCRBеПЧдљУеЇУзФ®дЇОжЮДеїЇжѓПдЄ™ж†ЈжЬђзЪДеПѓеПШеЯЇеЫ†з≠ЙдљНеЯЇеЫ†и∞±пЉМзДґеРОдљЬиАЕе∞ЖжХ∞жНЃзїЖеИЖдЄЇеЕ≠зІНдЄїи¶Бз±їеЮЛзЪДз≠ЙдљНеЯЇеЫ†и∞±пЉМдљЬиАЕзІ∞дєЛдЄЇеНХеАНеЮЛзїДгАВжѓПдЄ™ж†ЈжЬђзЪДз≠ЙдљНеЯЇеЫ†и∞±пЉМжМЙеНХеАНеЮЛзїДжОТеЇПпЉМе¶ВеЫЊ1AжЙАз§ЇпЉМеєґйЩДжЬЙеЕ≥йФЃж≥®йЗКгАВдљЬиАЕж†єжНЃдЄАиИђеОЯеИЩе∞ЖжѓПдЄ™ж†ЈжЬђеИЖдЄЇжЧ†/иљїеЇ¶irAEs(вЙ§2зЇІ)жИЦдЄ•йЗНirAEs(вЙ•3зЇІ)пЉМеН≥2зЇІжИЦжЫідљОзЇІеИЂзЪДirAEs(ењГиВМзВОгАБз•ЮзїПз≥їзїЯеТМи°Ажґ≤з≥їзїЯirAEsйЩ§е§Ц)дЄНдЉЪеҐЮеК†еПСзЧЕзОЗпЉМеєґдЄФйАЪеЄЄжЧ†йЬАеѓєж≤їзЦЧжЦєж°ИињЫи°МйЗНе§ІдњЃжФєеН≥еПѓжОІеИґпЉМиАМ3зЇІжИЦжЫійЂШзЇІеИЂзЪДirAEsеПѓиГљдЉЪжШЊиСЧеҐЮеК†еПСзЧЕзОЗеєґйЬАи¶БзїИж≠Ґж≤їзЦЧгАВ
дљЬиАЕињШиІВеѓЯеИ∞дЄ•йЗНirAEsзЪДеПСзФЯзОЗеЬ®еЕ≠дЄ™еНХеАНеЮЛзїДдЄ≠еЈЃеЉВжШЊиСЧпЉЪдЄАдЄ™еНХеАНеЮЛзїД(зїД2)зЪДжИРеСШпЉМеН†33%зЪДж†ЈжЬђпЉМдЉЉдєОдЄНеПЧдЄ•йЗНirAEsзЪДељ±еУН(0%зЪДйҐСзОЗпЉЫеЫЊ1BеНХеАНеЮЛ2(зЇҐиЙ≤)пЉМиАМеЕґдїЦеНХеАНеЮЛзїДдЄ≠14-44%зЪДжВ£иАЕжЬЙдЄ•йЗНзЪДirAEs (p=4.4EвИТ4пЉМFisherз≤Њз°Ѓж£Ай™М)гАВ
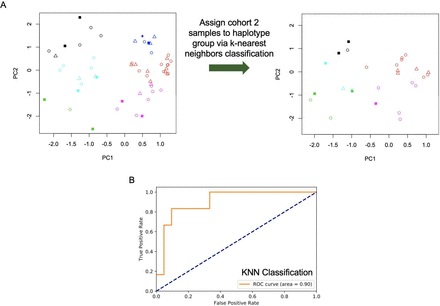
дЄЇдЇЖиѓДдЉ∞ињЩдЄАеПСзО∞зЪДз®≥еБ•жАІпЉМдљЬиАЕж£АжЯ•дЇЖйШЯеИЧ1зЪДж†ЈжЬђжШѓеР¶еПѓдї•зФ®дЇОйҐДжµЛйШЯеИЧ2зЪДдЄ•йЗНirAEs гАВйАЪињЗеѓєйШЯеИЧ1ж†ЈжЬђйЗНе§НдЄїжИРеИЖеИЖжЮРеТМkеЭЗеАЉиБЪз±їпЉМзДґеРОдљњзФ®еЊЧеИ∞зЪДеНХеАНеЮЛж†Зз≠ЊйАЪињЗkињСйВїеИЖжЮРе∞ЖйШЯеИЧ2ж†ЈжЬђеИЖйЕНеИ∞еНХеАНеЮЛзЊ§дљУгАВйАЪињЗеЖНжђ°иІВеѓЯеИ∞iraeеЬ®еНХеАНеЮЛзЊ§дљУдЄ≠зЪДйЭЮйЪПжЬЇеИЖеЄГ(еЫЊ2AпЉМ p=0.03, Fisherз≤Њз°Ѓж£Ай™М)пЉМж≤°жЬЙ襀ељТз±їдЄЇеНХеАНеЮЛзЊ§дљУ2зЪДж†ЈжЬђжЬЙдЄ•йЗНзЪДirAEsгАВдљЬдЄЇи°•еЕЕжЦєж≥ХпЉМ胥йЧЃжШѓеР¶дљњзФ®kињСйВїеИЖз±їеЩ®иЃ≠зїГйШЯеИЧ1з≠ЙдљНеЯЇеЫ†и∞±еТМirAEж†Зз≠Њ(0пЉЪirAEвЙ§2зЇІ;1пЉЪirAEвЙ•3зЇІ)еПѓдї•йҐДжµЛйШЯеИЧ2жВ£иАЕж†ЈжЬђдЄ≠жШѓеР¶е≠ШеЬ®дЄ•йЗНirAEгАВдїОжО•еПЧиАЕ-жУНдљЬиАЕзЙєеЊБжЫ≤зЇњ(жЫ≤зЇњдЄЛйЭҐзІѓдЄЇ0.90пЉМеЫЊ2B)зЪДеИЖжЮРеПѓдї•зЬЛеЗЇпЉМеИЖз±їеЩ®иГље§ЯйҐДжµЛйШЯеИЧ2дЄ≠зЪДirAEsгАВ
жЬАеРОпЉМдЄЇдЇЖжЈ±еЕ•дЇЖиІ£irAEsеЬ®еНХеАНеЮЛзЊ§дљУдєЛйЧіеЈЃеЉВеИЖеЄГзЪДеЯЇз°АпЉМйАЪињЗ胥йЧЃжШѓеР¶е≠ШеЬ®е∞ЖеНХеАНеЮЛзЊ§дљУ2дЄОеЕґдїЦеНХеАНеЮЛзЊ§дљУеМЇеИЖеЉАжЭ•зЪДз≠ЙдљНеЯЇеЫ†и∞±зЙєеЊБгАВж≠£е¶ВдєЛеЙНзЪДеЈ•дљЬжЙАз§ЇпЉМ22дЄ™еНХеАНеЮЛзїД2зЪДжИРеСШжѓФеЕґдїЦеНХеАНеЮЛзїДзЪДжИРеСШжЛ•жЬЙжЫіе∞СзЪДзЛђзЙєз≠ЙдљНеЯЇеЫ†еТМдЄНеЄЄиІБз≠ЙдљНеЯЇеЫ†(еЃЪдєЙдЄЇе≠ШеЬ®дЇОж†ЈжЬђйЫЖзЪД50%дї•дЄЛ)гАВињЩи°®жШОеНХеАНеЮЛзїД2жИРеСШеѓєиѓ•йШЯеИЧдЄ≠еЄЄиІБзЪДз≠ЙдљНеЯЇеЫ†еНХеАНеЮЛеАЊеРСдЇОзЇѓеРИпЉМиАМеЕґдїЦзїДзЪДжИРеСШеЕЈжЬЙжЫійЂШзЪДTRBVз≠ЙдљНеЯЇеЫ†жЭВеРИжАІпЉМеєґдЄФжРЇеЄ¶зљХиІБзЪДTRBVеНХеАНеЮЛ(еЬ®зЇњи°•еЕЕжЦЗдїґ1пЉЫзђђ2зїДзЛђзЙєз≠ЙдљНеЯЇеЫ†жХ∞еТМзљХиІБз≠ЙдљНеЯЇеЫ†жХ∞дЄОеЕґдїЦзїДжѓФиЊГпЉМPеАЉеИЖеИЂдЄЇ1.7EвИТ4еТМ3.6EвИТ13пЉМStudentвАЩs tж£Ай™М)гАВ
04 зїУиЃЇ
ICIжШѓдЄАз±їжЬЙжХИзЪДеЕНзЦЂж≤їзЦЧиНѓзЙ©пЉМзФ®дЇОж≤їзЦЧе§ЪзІНзЩМзЧЗпЉМе∞љзЃ°ICIзЫЄеЕ≥зЪДirAEsдїНзДґжШѓдЄАдЄ™еЕ≥йФЃзЪДжМСжИШгАВдљЬиАЕзЪДз†Фз©ґзїУжЮЬжФѓжМБдЇЖTCRBеЯЇеЫ†еЇІеЖЕзЪДйБЧдЉ†еПШеЉВжЬЙеК©дЇОICIsж≤їзЦЧеРОзЪДirAEsзЪДиІВзВєгАВдљЬиАЕзЪДж†ЈжЬђйЫЖеМЕжЛђдљњзФ®еНХдЄАеТМиБФеРИж£АжЯ•зВєйШїжЦ≠еЙВж≤їзЦЧе§ЪзІНзЩМзЧЗзЪДдЄ™дљУпЉМињЩи°®жШОTRBVе§ЪжАБжАІзЪДйҐДжµЛдїЈеАЉеєґдЄНе±АйЩРдЇОеНХдЄАзЩМзЧЗз±їеЮЛжИЦеЕНзЦЂж≤їзЦЧжЦєж°ИгАВжНЃжО®жµЛпЉМеЬ®иЗ™иЇЂеПНеЇФжАІTRBVз≠ЙдљНеЯЇеЫ†жРЇеЄ¶иАЕдЄ≠пЉМVDJйЗНзїДпЉМеН≥еПѓеПШ(V)гАБе§Ъж†ЈжАІ(D)еТМињЮжО•(J)еЕНзЦЂзРГиЫЛзЩљеЯЇеЫ†зЙЗжЃµдєЛйЧізЪДдљУзїЖиГЮйЗНзїДпЉМзїПеЄЄдЇІзФЯиЗ™иЇЂжКЧеОЯиѓЖеИЂзЪДTCRпЉМеЕґдЄ≠дЄАдЇЫдЄНиГљйАЪињЗиГЄиЕЇйШіжАІйАЙжЛ©жґИйЩ§гАВзЫЃеЙНзЪДTзїЖиГЮжИРзЖЯж®°еЮЛи°®жШОпЉМеЕЈжЬЙиЗ™иЇЂеПНеЇФжАІTCRзЪДTзїЖиГЮи¶БдєИ襀иГЄиЕЇйШіжАІйАЙжЛ©еЃМеЕ®жґИйЩ§пЉМи¶БдєИдљЬ䪯姱泿зЪДTзїЖиГЮеЬ®еС®еЫіжМБзї≠е≠ШеЬ®гАВеБЗиЃЊеРОиАЕеПѓиÚ襀ICIsйЗНжЦ∞жњАжіїдї•дїЛеѓЉirAEsгАВзђђдЇМзІНзЫЄеЃєзЪДеПѓиГљжАІжШѓпЉМICIsйЩНдљОдЇЖиГЄиЕЇйШіжАІйАЙжЛ©зЪДеКЯжХИпЉМеѓЉиЗіиЗ™иЇЂеПНеЇФжАІTRBVз≠ЙдљНеЯЇеЫ†жРЇеЄ¶иАЕдЇІзФЯдЄНжИРжѓФдЊЛзЪДе§ІйЗПиЗ™иЇЂеПНеЇФжАІTзїЖиГЮгАВ
жАїдєЛпЉМдљњзФ®йХњжЙ©еҐЮе≠РTCRBеЕ®еЇУжµЛеЇПиѓЖеИЂдЄ•йЗНirAEй£ОйЩ©дЄ™дљУзЪДиГљеКЫжЬЙеПѓиГљйАЪињЗйЩНдљОirAEеПСзЧЕзОЗеТМеЃЮзО∞еИ©зФ®жЫіе§Ъж†ЈеМЦзЪДеЕНзЦЂж£АжЯ•зВєи∞ГиКВеЙВзЪДдЄ™жАІеМЦеЕНзЦЂж≤їзЦЧжЦєж°ИжЭ•жФєеЦДжВ£иАЕзЪДйҐДеРОгАВ
еПВиАГжЦЗзМЃ
Stephen B, Hajjar J, Sarda S, et al. T- cell receptor beta variable gene polymorphism predicts immune- related adverse events during checkpoint blockade immunotherapy. Journal for ImmunoTherapy of Cancer 2023;11:e007236. doi:10.1136/jitc-2023-007236
